
分析 (1)依据Fe(CO)5的熔沸点低,且易溶于四氯化碳判断晶体类型;
(2)①比较非金属性,非金属性越强电负性越大;
②SO3气态为单分子,该分子中S原子形成3个δ键,没有孤对电子,与其互为等电子体的阴离子为CO32-,SiO32-,NO3-;
(3)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大;
解答 解:(1)Fe(CO)5的熔沸点低,且易溶于四氯化碳,依据分子晶体熔沸点低,且存在相似相溶原理,可知Fe(CO)5为分子晶体;
故答案为:分子晶体;
(2)①比较非金属性,非金属性越强电负性越大,非金属性O>S>P>Si,故答案为:O>S>P>Si;
②SO3气态为单分子,该分子中S原子形成3个δ键,没有孤对电子,所以是sp2杂化,与其互为等电子体的阴离子为CO32-,SiO32-,NO3-,故答案为:sp2;CO32-,SiO32-,NO3-;
(3)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′,
故答案为:>;Si3N4 晶体中Si周围有四个N原子,Si为sp3杂化,键角N-Si-N为109°28’,而N原子周围连接三个Si原子,N原子上有一对孤对电子,N原子也是sp3杂化,但由于孤对电子对成键电子对的排斥作用较大,使得Si-N-Si键角小于109°28’.
点评 本题综合考查物质的结构和性质,侧重于学生的分析能力的考查,注意把握杂化类型以及等电子体的判断,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
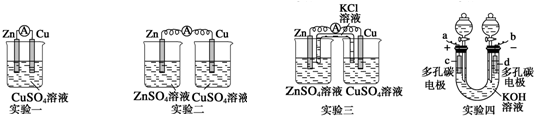
 按要求完成下列小题.
按要求完成下列小题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开啤酒盖,立即有气体逸出 | |
| B. | 新制的氯水在光照条件下颜色变浅 | |
| C. | NO2和N2O4的混合体系,压缩容器体积,颜色变深 | |
| D. | 工业生产硫酸的过程中使用过量的O2,以提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
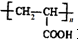 )的合成路线:
)的合成路线:
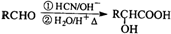 (R为烃基)
(R为烃基)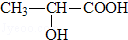

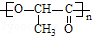 +nH2O.
+nH2O. 合成
合成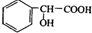 的合成路线
的合成路线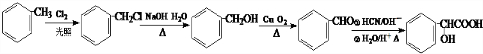 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 对N2+3H2?2NH3的反应,使用铁触媒可加快合成氨反应的速率 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ③④⑤ | C. | ②④⑤⑥ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com