
【题目】研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如下。
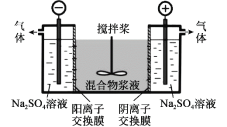
下列说法不正确的是( )
A.阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
B.CrO42-通过阴离子交换膜进入阳极室,从而实现与浆液的分离
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.适当增大电压,CrO42-也可在阴极室转化为Cr(OH)3除去
【答案】D
【解析】
电解时,CrO42通过阴离子交换膜向阳极移动,在阳极氢氧根离子失电子发生氧化反应,OH放电后,阳极池酸度增强,发生反应2CrO42+2H+=Cr2O72+H2O,阴极发生还原反应生成氢气和NaOH,以此解答该题。
A.阳极发生氧化反应,该电极的电极反应式为:2H2O - 4e- = O2↑+4H+,故A正确;
B.电解时,CrO42-通过阴离子交换膜向阳极移动,通电后CrO42-将通过阴离子膜进入阳极室,从而实现与浆液的分离,故B正确;
C. 阴极发生还原反应生成氢气,同时还会得到硫酸钠、氢氧化钠, Al(OH)3和MnO2中的氢氧化铝可以溶于氢氧化钠,氢氧化钠可用于固体混合物Al(OH)3和MnO2的分离,故C正确;
D. 适当增大电压,电解时,右池为阳极,阴离子向阳极移动,CrO42通过阴离子交换膜向阳极移动,从而CrO42-能从浆液中分离出,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】在一定条件下,向2L密闭容器中加入2molX、1molY。发生如下反应:2X(g)+Y(?) ![]() 3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
A. 反应开始至平衡时,用X表示的化学反应速率为1.2 mol/(L·min)
B. 该反应平衡常数表达式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新达平衡时X的体积分数一定增大
D. 若使容器体积变为1 L,Z的物质的量浓度一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1)K2FeO4的制备:

①i中反应的离子方程式是_______。
② 将ii中反应的离子方程式补充完整:____Fe3+ +____OH- +____ClO-=____FeO42-+_______+________
③ iii中反应说明溶解度:Na2FeO4_______K2FeO4(填“>”或“< ”)。
(2)K2FeO4的性质:
i. 将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ii. 将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii. 将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快。
① K2FeO4溶于蒸馏水的化学反应方程式是_______。
② K2FeO4的氧化性与溶液pH的关系是_______。
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:
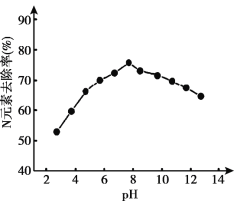
① K2FeO4脱氮的最佳pH是_____。
② 根据图推测,pH = 4时生活垃圾渗透液中含氮物质主要以______形式存在。
③ pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COONa稀溶液中分别改变如下条件,能使比值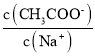 一定减小的是
一定减小的是
①固体NaOH;②少量冰醋酸;③固体NaHSO4;④固体CH3COONa;⑤降温;
A.①③B.①④C.②⑤D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中的H2A、HA-、A2 -的物质的量分数δ(x)随pH的变化如图所示。下列说法错误的是

A.pH =1.9时,c(Na+)<c(HA-)+2c(A2-)
B.当c(Na+)=c(H2A)+c(HA-)+c(A2-)时,溶液pH>7
C.pH=6时,c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.lg[Ka2(H2A)]=-7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是重要的防腐剂。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图1所示(部分夹持装置略)。
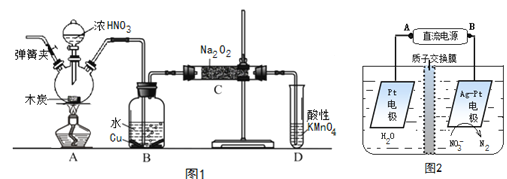
已知:
①2NO+Na2O2→2NaNO2
②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
回答下列问题:
(1)写出浓硝酸与木炭反应的化学方程式_____________________________________________;
(2)B中观察到的主要现象是___________________________________________________________,
D装置的作用是______________________________________________;
(3)检验C中产物有亚硝酸钠的方法是______________________________________________;
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和____________,为避免产生这些副产物应在B、C装置间增加装置E,仪器E的名称是___________,E中盛放的试剂应是_________(填字母);
A.浓H2SO4B.碱石灰 C.无水CaCl2
(5)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭___________g 。
(6)反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理,电化学降解NO3-的原理如上图2所示。25℃时,反应进行10min,溶液的pH由7变为12 。
电源正极为________(填A或B),阴极反应式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体![]() 。
。
Ⅰ![]() (查阅资料)
(查阅资料)
(1)![]() 是无色透明晶体,易溶于水,其稀溶液与
是无色透明晶体,易溶于水,其稀溶液与![]() 溶液混合无沉淀生成。
溶液混合无沉淀生成。
(2)向![]() 和
和![]() 混合溶液中通入
混合溶液中通入![]() 可制得
可制得![]() ,所得产品常含有少量
,所得产品常含有少量![]() 和
和![]() 。
。
(3)![]() 易被氧化;
易被氧化;![]() 难溶于水,可溶于稀盐酸。
难溶于水,可溶于稀盐酸。
Ⅱ![]() (制备产品)
(制备产品)
实验装置如图所示![]() 省略夹持装置
省略夹持装置![]() :
:

实验步骤:
(1)检查装置A、B气密性的方法是______,如图示加入试剂。仪器b的名称是______;E中的试剂是______![]() 选填下列字母编号
选填下列字母编号![]()
A.稀![]()
B.饱和![]() 溶液
溶液
C.饱和![]() 溶液
溶液
D.NaOH溶液
(2)先向C中烧瓶加入![]() 和
和![]() 的混合溶液,再向A中烧瓶滴加浓
的混合溶液,再向A中烧瓶滴加浓![]() 。
。
(3)待![]() 和
和![]() 完全消耗后,结束反应。过滤C中的混合物,滤液经蒸发、结晶、过滤、______、干燥、得到产品
完全消耗后,结束反应。过滤C中的混合物,滤液经蒸发、结晶、过滤、______、干燥、得到产品![]() 填写操作名称
填写操作名称![]() 。
。
Ⅲ![]() (探究与反思)
(探究与反思)
(1)为验证产品中含有![]() 和
和![]() ,该小组设计了以下实验方案,请将方案补充完整
,该小组设计了以下实验方案,请将方案补充完整![]() 所需试剂从稀
所需试剂从稀![]() 、稀
、稀![]() 、稀盐酸、蒸馏水中选择
、稀盐酸、蒸馏水中选择![]() .取适量产品配成稀溶液,滴加足量
.取适量产品配成稀溶液,滴加足量![]() 溶液,有白色沉淀生成,______,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有
溶液,有白色沉淀生成,______,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有![]() 和
和![]() 。
。
(2)为减少装置C中生成![]() 的量,在不改变原有装置的基础上对实验步骤
的量,在不改变原有装置的基础上对实验步骤![]() 进行了改进,改进后的操作是______。
进行了改进,改进后的操作是______。
(3)![]() 的溶解度随温度升高显著增大,所得产品通过______方法提纯。
的溶解度随温度升高显著增大,所得产品通过______方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C6H14的各种同分异构体中所含甲基数和它的一氯取代物的数目分别是( )
A.2个甲基,能生成4种一氯代物 B.4个甲基,能生成1种一氯代物
C.3个甲基,能生成5种一氯代物 D.4个甲基,能生成4种一氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对碳、氮、磷等常见元素的化合物性质进行如下研究.请按要求回答问题.
![]() 甲同学用图l所示装置
甲同学用图l所示装置![]() 部分夹持装置略
部分夹持装置略![]() 探究NO与
探究NO与![]() 的反应.
的反应.
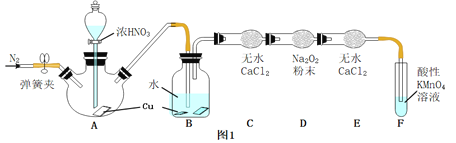
查阅资料:
![]()
![]()
酸性条件下,NO或![]() 都能与
都能与![]() 反应生成
反应生成![]() 和
和![]()
![]() 中反应的化学方程式是 ______
中反应的化学方程式是 ______ ![]() 中观察到的主要现象是 ______ ,F装置的作用是 ______ .
中观察到的主要现象是 ______ ,F装置的作用是 ______ .
![]() 在反应前,打开弹簧夹,通入一段时间
在反应前,打开弹簧夹,通入一段时间![]() ,目的是 ______ .
,目的是 ______ .
![]() 充分反应后,检验D装置中发生反应的实验是 ______ .
充分反应后,检验D装置中发生反应的实验是 ______ .
![]() 乙同学查阅有关弱酸的电离平衡常数:
乙同学查阅有关弱酸的电离平衡常数:
化学式 |
| HCN |
|
电离平衡常数 |
|
|
|
则该温度下相同pH的![]() 、
、![]() 、
、![]() 、
、![]() 溶液的物质的量浓度由大到小的顺序为 ______
溶液的物质的量浓度由大到小的顺序为 ______ ![]() 填编号
填编号![]() .
.
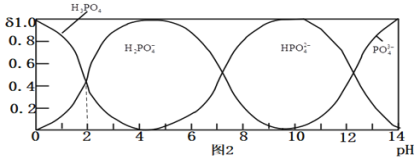
![]() 磷酸
磷酸![]() 为一种三元酸,其在水溶液中各种存在形式物质的量分数
为一种三元酸,其在水溶液中各种存在形式物质的量分数![]() 随pH的变化曲线如图2:
随pH的变化曲线如图2:
![]() 溶液中,
溶液中,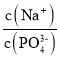 ______
______ ![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 向
向![]() 溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为 ______ .
溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为 ______ .
![]() 由图推断
由图推断![]() 溶液中各种微粒浓度关系是 ______
溶液中各种微粒浓度关系是 ______ ![]() 填选项字母
填选项字母![]()
A.![]()
B.![]()
C.![]()
D.![]()
![]() 假设在
假设在![]() 时测得
时测得![]() 溶液的
溶液的![]() ,近似计算出
,近似计算出![]() 第一步水解的水解常数
第一步水解的水解常数![]() 用
用![]() 表示
表示![]()
![]() ______
______ ![]() 忽略
忽略![]() 第二、第三步水解,结果保留两位有效数字
第二、第三步水解,结果保留两位有效数字![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com