
����Ŀ��ʵ�����Է���мΪԭ���Ʊ������������壨FeC2O4��xH2O�����������£�

��֪����pH>4ʱ��Fe2+�ױ�����������
��������ʵ��ܽ��������ͼ��

��1���ٷ���м�ڽ��С��ܽ⡱ǰ����Ҫ��5%��Na2CO3 ��Һ�м��������ӣ���ϴ�Ӹɾ���Na2CO3��Һ��������____________��
����ϡ�������ҺpH��1��2��Ŀ�ģ�һ������Fe2+ ��NH4+��ˮ�⣻���� ________��
�۲���I��Ϊ�˵õ�(NH4)2SO4��FeSO4��6H2O�������IӦ��������Ũ�����ᾧ�����ˡ���ô����ʱ���˵��¶�Ϊ__________��
�ܼ���FeC2O4��xH2O�����Ƿ�ϴ�Ӹɾ��ķ�����____________��
��2��ͨ������֪Ũ�ȵ����Ը��������Һ�ⶨ������������Ĵ��ȡ���֪����������MnO4��ת��ΪMn2+��д��MnO4����Fe2+��Ӧ�����ӷ���ʽ��____________��
��3��ij�о���ѧϰС��������������������Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3�����������Ʊ��ϴ�����FeSO4��Һ���ٺϳ�FeC2O4��xH2O���벹�������������������Ʊ�����FeSO4��Һ��ʵ�鲽�裨��ѡ�õ��Լ������ۡ�ϡ�����NaOH��Һ������һ���������������м���������ϡ�����ַ�Ӧ�����ˣ�____________�����ˣ��õ��ϴ�����FeSO4��Һ��
���𰸡������۷�ֹFe2+������60������ȡ�������һ��ϴ��Һ���Թ��У�����BaCl2��Һ�����ް�ɫ�����������ϴ�Ӹɾ�5Fe2++MnO4��+ 8H+��Mn2++ 5Fe3++4H2O����Һ�еμӹ�����NaOH��Һ�����ˣ����ϴ�ӹ��壬������м�������ϡ������������ȫ�ܽ⣬�ټ������������ۡ�
��������
����м����������Һ�ܽ⣬�����������Һ�ᾧ���������������壬��ˮ�ܽ⣬���뼸��ϡ�����ֹ��������ˮ�⣬�����������������ӣ����˵õ����������ظ���ء�����������Һ�����������õ����������ؾ��壻
(1)����5%Na2CO3��Һ�м��������ӣ���ϴ�Ӹɾ�������̼����ˮ���Լ��ԣ����ۻᷢ��ˮ����������ˮ������ϴȥ��������ȥ�����ۣ��ʴ�Ϊ�������ۣ�
�ڸ�����Ϣ��pH>4ʱ��Fe2+�ױ����������������ϡ�������ҺpH��1��2���Է�ֹFe2+���������ʴ�Ϊ����ֹFe2+��������
�۸���ͼ��60��ʱ�������������ܽ�����Ϊ�˵õ�(NH4)2SO4��FeSO4��6H2O���ڽ�������Ũ�����ᾧ����ʱ����60�棬��������ȵؼ��������������������ʴ�Ϊ��60�����ң�
�ܼ���FeC2O4��xH2O�����Ƿ�ϴ�Ӹɾ��ķ�����ȡ���һ��ϴ��Һ������Ƿ�����������ӽ�����Ʒ�������С�Թ�ȡ�������һ��ϴ��Һ������BaCl2��Һ������ְ�ɫ������˵������û��ϴ�Ӹɾ�����������ϴ�Ӹɾ����ʴ�Ϊ����С�Թ�ȡ�������һ��ϴ��Һ������BaCl2��Һ������ְ�ɫ������˵������û��ϴ�Ӹɾ�����������ϴ�Ӹɾ���
(2)����֪Ũ�ȵ����Ը��������Һ�ⶨ������������Ĵ��ȡ���֪����������MnO4��ת��ΪMn2+����Ӧ�����ӷ���ʽΪ5Fe2++MnO4��+ 8H+��Mn2++ 5Fe3++4H2O���ʴ�Ϊ��5Fe2++MnO4��+ 8H+��Mn2++ 5Fe3++4H2O��
(3)������������(��Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3 )�Ʊ�FeSO47H2O���壬ҪŪ���������ÿһ����ԭ����ע������������м���������ϡ���ᣬFe2O3��Al2O3���������ᷴӦ���ֱ�����Fe2(SO4)2��Al2(SO4)2��SiO2����Ӧ���ȹ��˰�SiO2��ȥ��Ȼ������Һ�еμӹ�����NaOH��Һ�����ˣ����ϴ�ӹ��壬������м�������ϡ������������ȫ�ܽ⣬�ټ������������ۣ���ֽ�����ˣ����õ�FeSO4��Һ���ٸ����̷��ܽ�����ߣ�60��ʱ�̷����ܽ����ɼ���Ũ����60��ı�����Һ��Ȼ����ڱ�ˮ����ȴ����ȴ�ᾧ��0�棬��ʱ�����ľ��������ģ�֮����ˣ�ϴ�ӣ����º�ɣ��ʴ�Ϊ������Һ�еμӹ�����NaOH��Һ�����ˣ����ϴ�ӹ��壬������м�������ϡ������������ȫ�ܽ⣬�ټ������������ۣ���ֽ��衣


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʷ����˵����ȷ���ǣ���
A. SO2��CaO��K2O���Ǽ���������
B. BaSO4��NaCl��KNO3��Һ���ǵ����
C. ����ռ��ʯ�Ҷ��Ǽ�
D. ϡ������������������Һ���ǽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ͪ��X�����ж���������ԣ�һ�������¿ɷֱ�ת��ΪY��Z��

����˵����ȷ���ǣ�������
A. X��Y��Z�о���������̼ԭ��
B. Y�ܷ�����������ԭ��ȡ����Ӧ
C. һ�������£�1 mol X�������5 mol H2�����ӳɷ�Ӧ
D. 1 mol Z�����뺬3 mol NaOH����Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������������������������������������ǣ� ��
A.D3O+
B.Li+
C.OD��
D.OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ�Ӻ�ZAX����һ�����Ӻų�һ�����ӣ�����Ϊ���������ӣ��ɴ˿�֪�� ��
A.A=7��Z=3
B.A=7��Z=4
C.A=8��Z=3
D.A=8��Z=4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�أ�Ce������ϵ��������Ȼ�����ߵ�һ�֣�������̬��+3��+4����ĺϽ����£������������������ƽ��������
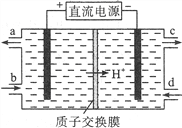
��1�������к��д�������Ⱦ��NO�����Ա�Ce4+��Һ���գ�����NO2����NO3�����������ʵ���֮��Ϊ1��1�����÷�Ӧ�������뻹ԭ�������ʵ���֮��Ϊ___________��
��2���ɲ��õ�ⷨ����������Һ�е�NO2��ת��Ϊ�����ʣ�ͬʱ����Ce4+����ԭ������ͼ��ʾ��
��Ce4+�ӵ��۵�__________������ĸ���)��������
��д�������ĵ缫��Ӧʽ____________________________��ÿ����1mol NO2����������H+���ʵ�������______mol��
��3����Ԫ������Ȼ����Ҫ�Է�̼����ʽ���ڣ���Ҫ��ѧ�ɷ�ΪCeFCO3����ҵ�����÷�̼�����ȡCeCl3��һ�ֹ����������£�
�����չ����з�������Ҫ��Ӧ����ʽΪ______________________________________��
�������������ͬѧ��Ϊ��ϡ�����H2O2�滻������ã�����������_________________________��
��Ce(BF4)3��KBF4��Ksp�ֱ�Ϊa��b����Ce(BF4)3(s) + 3KCl(aq)![]() 3KBF4(s) + CeCl3 (aq)ƽ�ⳣ��Ϊ______________________��
3KBF4(s) + CeCl3 (aq)ƽ�ⳣ��Ϊ______________________��
������CeCl3��6H2O��NH4Cl�Ĺ�������ɵõ���ˮCeCl3������NH4Cl��������______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ������ˮ����ɫ��dz���������ڣ� ��
A.��ӷ���
B.������ȡ����Ӧ
C.����ȡ����ˮ�е���
D.�����˼ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D���ֽ������±���װ�ý���ʵ�顣
װ�� |
|
|
|
���� | ���۽���A�����ܽ� | C���������� | A����������� |
����ʵ������ش��������⣺
��1��װ�ü��и����ĵ缫��Ӧʽ��__��
��2��װ�����������ĵ缫��Ӧʽ��__��
��3��װ�ñ�����Һ��pH__����������С�����䡱����
��4�����ֽ�����������ǿ������˳����__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ����ȡ��̽���������ʣ�������װ��(���ּг�װ������ȥ)����ʵ�顣[��ȡ�����ķ�Ӧԭ����2NH4Cl+Ca(OH)2=CaCl2+2NH3��+2H2O]

��ʵ��̽����
(1)��������ԭ����ʵ������ȡ����Ӧѡ����ͼ�� ����װ�ý���ʵ�顣
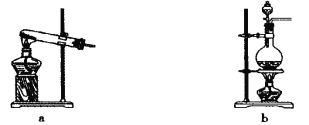
(2)Bװ���еĸ������ѡ�� (���ʯ�ҡ���Ũ���ᡱ)��
(3)��5.35 g NH4Cl����������Ca(OH)2��Ӧ�������Ƶñ�״���°��������Ϊ L��(NH4Cl��Ħ������Ϊ53.5 g��mol��1)
(4)����ͨ��C��Dװ��ʱ����ֽ��ɫ�ᷢ���仯���� (�C����D��)��
(5)��ʵ�����һ��ʱ���ѹEװ���еĽ�ͷ�ιܣ�����1��2��Ũ���ᣬ�ɹ۲쵽�������� ��
(6)Fװ���е���©�������� ��
����չӦ�á�
(7)ijͬѧ�ð����͵μӷ�̪��ˮ����Ȫʵ�飬������ƿ�ڲ�����ɫ��Ȫ������˵���������� ����(�����)��
a����ԭ�� b����������ˮ c����ˮ��Ӧ���ɼ�������
(8)��������;�ܹ㡣����ð����������������� 8NH3 + 6NO2 =7N2 + 12H2O
�÷�Ӧ�а������� (������ԡ���ԭ�ԡ�)��
�����оٳ���������һ����; ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com