
| A. | 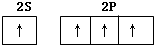 | B. | 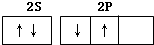 | ||
| C. |  | D. | 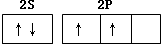 |
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑦⑧⑨ | B. | ③④⑤⑦⑧ | C. | ②③⑥⑦⑨ | D. | ④⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 加催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用标准酸液滴定未知碱液时,若酸式滴定管未润洗,则测定结果偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应A(g)+B(g)?nC(g)△H=x kJ•mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如右图.下列有关叙述一定正确的是( )
已知反应A(g)+B(g)?nC(g)△H=x kJ•mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如右图.下列有关叙述一定正确的是( )| A. | a条件下的反应速率小于b条件下的反应速率 | |
| B. | 其他条件相同时,a表示有催化剂,b表示无催化剂 | |
| C. | 其他条件相同,若a、b表示不同压强下的反应,则n>2 | |
| D. | 其他条件相同,若a、b表示不同温度下的反应,则x>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H20 | |
| B. | 碳酸钠溶液与少量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++SO42-═H2O+BaSO4↓ | |
| D. | 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
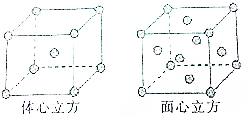 X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:
X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com