
【题目】碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种无毒、用途广泛的化工原料,被誉为当今有机合成的“新基石”。
(1)浙江大学用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC的研究开发。已知:
(ⅰ)CO的标准燃烧热:283.0 kJmol﹣1,
(ⅱ)1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量
(ⅲ)2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) △H=﹣15.5kJmol﹣1
CH3OCOOCH3(g)+H2O(g) △H=﹣15.5kJmol﹣1
则2CH3OH(g)+CO(g)+1/2O2(g) ![]() CH3OCOOCH3(g)+ H2O(l) △H=______.
CH3OCOOCH3(g)+ H2O(l) △H=______.
该反应在常压和70~120℃条件下就能自发反应的原因是___________________.
(2)甲醇和CO2可直接合成DMC:
2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g),但由于甲醇转化率通常不会超过1%,因此制约该反应走向工业化生产.
CH3OCOOCH3(g)+H2O(g),但由于甲醇转化率通常不会超过1%,因此制约该反应走向工业化生产.
①写出该反应平衡常数表达式:______________________________.
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是__________(选填编号)。
A.v正(CH3OH)=2v逆(CO2) B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变 D.容器内压强不变

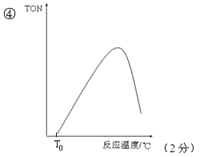
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10﹣5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。(计算公式:TON=转化的甲醇的物质的量/催化剂的物质的量)在该温度下,最佳反应时间是_____;4~10h内DMC的平均反应速率是_______.
④如果在其它条件不变的情况下,研究反应温度对甲醇转化数(TON)的影响,请在图的坐标系中画出从投入反应物开始,随着反应温度不断升高(不考虑温度对催化剂活性的影响),TON变化的曲线示意图(假设起始温度为T0℃)__________________.

⑤假设在密闭容器中发生上述反应,达到平衡时下列措施能提高TON值的是______.
A.往反应体系中添加催化剂 B.往反应体系中添加吸水剂
C.从反应体系中分离出CO2 D.扩大容器的体积.
【答案】(1)-342.5kJ·mol-1(2分),因为该反应△H<0,△S<0(2分)
(2) ①![]() (2分)
(2分)
② AD(2分)
③ 10(1分) 7.5×10-4mol·L-1·h-1(2分)
⑤B (2分)
【解析】
试题(1)由CO的标准燃烧热:-283.0 kJmol-1得:ⅰCO(g)+1/2O2 (g)====CO2(g);ΔH ="-" 283 kJ·mol-1,1mol H2O(l)完全蒸发变成H2O(g)需吸收44 kJ的热量得:ⅱH2O(l)====H2O(g);ΔH ="+" 44kJ·mol-1,ⅲ 2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) △H=-15.5 kJmol-1,根据盖斯定律:ⅰ-ⅱ+ⅲ得2CH3OH(g)+CO(g)+ 1/2O2(g)
CH3OCOOCH3(g)+H2O(g) △H=-15.5 kJmol-1,根据盖斯定律:ⅰ-ⅱ+ⅲ得2CH3OH(g)+CO(g)+ 1/2O2(g)![]() CH3OCOOCH3(g)+H2O(l) △H=(-283-44-15.5)kJmol-1=-342.5kJ·mol-1。该反应该反应为放热的熵减反应,根据H-TS<0能自发进行,该反应在低温下自发进行,故该反应在常压和70~120℃条件下就能自发反应是因为该反应△H<0,△S<0。
CH3OCOOCH3(g)+H2O(l) △H=(-283-44-15.5)kJmol-1=-342.5kJ·mol-1。该反应该反应为放热的熵减反应,根据H-TS<0能自发进行,该反应在低温下自发进行,故该反应在常压和70~120℃条件下就能自发反应是因为该反应△H<0,△S<0。
(2)① 化学平衡常数等于生成物平衡浓度系数次幂的积与反应物平衡浓度系数次幂的积的比,根据化学方程式写出该反应平衡常数表达式为:![]() 。②A、v正(CH3OH)= 2v逆(CO2) ,正逆反应速率相等,反应已达平衡状态,正确;B、反应从正向开始,CH3OCOOCH3与H2O的物质的量之比不随反应的进行而变化,不能作为平衡标志,错误;C、该反应在恒容密闭容器进行,容器内气体的质量不变,气体的密度不随反应的进行而变化,气体密度不变,不能作为平衡标志,错误;D、该反应为反应前后气体物质的量减小的反应,容器内压强不变,说明反应已达平衡,正确,选AD。
。②A、v正(CH3OH)= 2v逆(CO2) ,正逆反应速率相等,反应已达平衡状态,正确;B、反应从正向开始,CH3OCOOCH3与H2O的物质的量之比不随反应的进行而变化,不能作为平衡标志,错误;C、该反应在恒容密闭容器进行,容器内气体的质量不变,气体的密度不随反应的进行而变化,气体密度不变,不能作为平衡标志,错误;D、该反应为反应前后气体物质的量减小的反应,容器内压强不变,说明反应已达平衡,正确,选AD。
③根据图像分析反应时间为10h时TON最大,甲醇的转化率最高,故最佳反应时间是10h;根据题给信息和图像知4h时转化的甲醇的物质的量=20×6×10-5mol=1.2×10-3mol,10h时转化的甲醇的物质的量="35" ×6×10-5mol =2.1×10-3mol ,则4~10 h内甲醇的物质的量变化,△n(CH3OH)=0.9×10-3mol ,v (DMC)="1/2v" (CH3OH)=△n(CH3OH)/2V△t=7.5×10-4mol·L-1·h-1;④在其它条件不变的情况下,随着反应温度不断升高,从投入反应物开始,转化的甲醇的物质的量逐渐增大,TON逐渐增大,当反应达到平衡状态,转化的甲醇的物质的量最大,TON最大,该反应放热,再升高温度,平衡逆向移动,转化的甲醇的物质的量又逐渐减少,TON又逐渐减小,图像见答案。⑤A、往反应体系中添加催化剂,平衡不移动,转化的甲醇的物质的量不变,催化剂的物质的量增加,TON值减小,错误;B、往反应体系中添加吸水剂 ,平衡正向移动,转化的甲醇的物质的量增大,催化剂的物质的量不变,TON值增大,正确;C、从反应体系中分离出CO2,平衡逆向移动,转化的甲醇的物质的量减小,催化剂的物质的量不变,TON值减小,错误;D、扩大容器的体积,平衡逆向移动,转化的甲醇的物质的量减小,催化剂的物质的量不变,TON值减小,错误,选B。


科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)![]() 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A. 2.5mol C B. 2 mol A、2 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C D. 2 mol A、3 mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产中用途广泛。
Ⅰ利用生产硼砂的废渣一一确镁泥(主要成分为MgCO3.SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3:Mg(OH)2:2H2O]的工业流程如下:
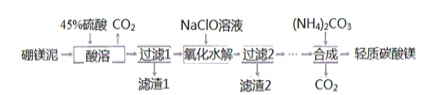
(1)写出“酸溶"一步中,MgCO3和硫酸反应的离子方程式________________________。
(2)滤渣2的主要成分有MnO2和____,写出生成MnO2的离子方程式_____________。
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是________。
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
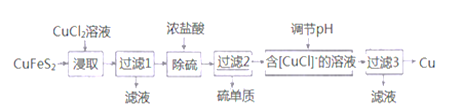
已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_______________。
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为__________。
(6)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是______。(填离子符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中正确的是( )
A.化学键存在于原子之间,也存在于分子之间
B.两个原子之间的相互作用叫做化学键
C.离子键是阴、阳离子之间的相互吸引力
D.化学键通常是指相邻的两个或多个原子之间强烈的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列5 种物质:①空气 ②CO2 ③乙醇 ④CaCO3 ⑤Al(OH)3;按要求填空(填代号):
(1)属于混合物的是_______;
(2)属于氧化物的是_______;
(3)属于碱的是_______;
(4)属于有机物的是_______;
(5)属于盐的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诗词是中华民族灿烂文化的瑰宝。下列古诗中不涉及化学变化的是( )
A.忽如一夜春风来,千树万树梨花开
B.爆竹声中一岁除,春风送暖入屠苏
C.落红不是无情物,化作春泥更护花
D.春蚕到死丝方尽,蜡炬成灰泪始干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清透明的溶液中,下列各组离子中能大量共存的是
A. K+、H+、SO42—、OH— B. Ba2+、K+、SO42—、NO3—
C. Na +、H+、Cl—、CO32- D. Na +、Cu2+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
Ⅰ.制备Cu2O
(1)电解法:工业上用铜作阳极,钛片为阴极,电解一定浓度的NaOH 溶液可制备氧化亚铜,写出阳极的电极反应式为_____________________
(2)微乳液-还原法:在 100℃ Cu(NO3)2 的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
已知: N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol
Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol
4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol
则由N2H4 和Cu(OH)2 反应制备 Cu2O 的热化学方程式为 ________________________。
Ⅱ.工业上用Cu2O 与 ZnO 组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
(1)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是(_______)
CH3OH(g)已达平衡状态的是(_______)
A.当反应的热效应△H = -90.8 kJ/mol 时反应达到平衡状态
B.在恒温恒压的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒容的容器中,气体的平均摩尔质量不再变化
(2)在 T1℃时,体积为 2 L 的恒容容器中充入物质的量之和为 3mol 的 H2 和CO,当起始 n(H2)/n(CO)= 2 时,经过 5min 达到平衡,CO 的转化率为 0.6,则0~5min 内平均反应速率 v (H2)=___;该温度下的平衡常数为__________________ ;若此时再向容器中加入CO(g) 和 CH3OH(g)各 0.4mol,达新平衡时 H2 的转化率将 ______(填“增大”、 “减小”或“不变”);
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com