
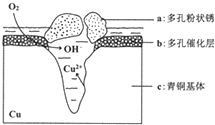
 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.分析 (1)原子核外电子层数与其周期数相等,Cu原子核外有4个电子层;
(2)Sn、Pb的物质的量之比=$\frac{119g}{119g/mol}$:$\frac{20.7g}{207g/mol}$=1mol:0.1mol=10:1,根据N=nNA知,物质的量之比等于其个数之比;
(3)A.催化剂降低了反应的活化能,增大活化分子百分数;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会;
C.催化剂改变反应路径,但焓变不变;
D.平衡常数只与温度有关;
(4)Ag2O与有害组分CuCl发生复分解反应,则二者相互交换成分生成另外的两种化合物;
(5)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀;
③n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积.
解答 解:(1)原子核外电子层数与其周期数相等,Cu原子核外有4个电子层,所以Cu元素位于第四周期,故答案为:四;
(2)Sn、Pb的物质的量之比=$\frac{119g}{119g/mol}$:$\frac{20.7g}{207g/mol}$=1mol:0.1mol=10:1,根据N=nNA知,物质的量之比等于其个数之比,所以Sn、Pb原子个数之比为10:1,故答案为:10:1;
(3)A.催化剂降低了反应的活化能,增大活化分子百分数,故A正确;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会,所以反应速率增大,故B正确;
C.催化剂改变反应路径,但焓变不变,故C错误;
D.平衡常数只与温度有关,温度不变,平衡常数不变,与催化剂无关,故D错误;
故选AB;
(4)Ag2O与有害组分CuCl发生复分解反应,则二者相互交换成分生成另外的两种化合物,反应方程式为Ag2O+2CuCl=2AgCl+Cu2O,
故答案为:Ag2O+2CuCl=2AgCl+Cu2O;
(5)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,故答案为:c;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
③n[Cu2(OH)3Cl]]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子得n(O2)=$\frac{0.02mol×2×2}{4}$=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,故答案为:0.448.
点评 本题考查较综合,侧重考查学生自身综合应用及计算能力,涉及氧化还原反应计算、离子方程式及复分解反应方程式的书写、原电池原理、催化剂的作用等知识点,利用原电池原理、物质性质及转移电子守恒进行解答,易错点是(3)题,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 由分子组成的物质中不一定存在共价键 | |
| B. | 金刚石、石墨、足球烯均是碳元素的同素异形体,性质都相似 | |
| C. | 由非金属元素组成的晶体一定是分子晶体 | |
| D. | 仅由非金属元素组成的物质不可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用盐酸除去铜粉中混有的铁粉 | |
| B. | 用浓盐酸和MnO2制氯气 | |
| C. | 用盐酸跟氢氧化钠溶液反应 | |
| D. | 盐酸和硝酸银溶液反应生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
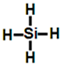 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的水中含有0.5NA个水分子 | |
| B. | 含有1molHCl的盐酸中离子总数为NA个 | |
| C. | 1molO2和H2的混合气体中含有NA个分子 | |
| D. | 1mol大米中含有NA个大米粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

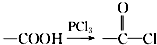 ,请回答以下问题:
,请回答以下问题: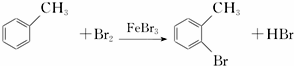 .
.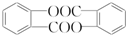 .
.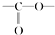 结构
结构查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15种 | B. | 16种 | C. | 17种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si有良好的半导体性能,可用于制备光导纤维 | |
| B. | CO2通入CaCl2溶液中,先有沉淀,后沉淀消失 | |
| C. | 2-氯甲苯的结构简式: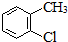 | |
| D. | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,说明Na2O2变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成单质的分子中一定含有共价键 | |
| B. | 由非金属元素组成的化合物可能是离子化合物 | |
| C. | 非极性键只存在单质分子里 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com