
| A. | 原子半径:Y>Z>W>X | B. | 简单气态氢化物的热稳定性:X>Z | ||
| C. | 野外钢轨焊接中常用到Y的单质 | D. | 加热条件下Q可氧化X、Y、Z的单质 |
分析 X的最高正化合价与Z的相同,应位于同一主族,Z原子的最外层电子数是内层电子数的0.4倍,则Z为Si元素,X为C元素,Y元素的周期序数等于族序数,应为Al元素,W的最高价氧化物对应的水化物的浓溶液Q是实验室常用的气体干燥剂,W为S元素,Q为硫酸,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:由以上分析可知X为C、Y为Al、Z为Si、W为S元素,Q为硫酸.
A.由于Y、Z、W同周期,原子序数依次增大,同一周期,从左到右半径在减小,原子半径Y>Z>W,X为C,原子半径最小,故原子半径为Y>Z>W>X,故A正确;
B.非金属性C>Si,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.Y为Al,可用铝热放焊接钢轨,故C正确;
D.加热硫酸,分解生成三氧化硫和水,不能得到单质,故D错误.
故选D.
点评 本题考查结构性质位置关系应用,为高频考点,侧重于学生的分析能力的考查,推断元素是解题关键,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径从大到小为R W Z Y X | |
| B. | 电解熔融状态下W和R形成的化合物可得到单质W | |
| C. | 0.1mol/L的Y的氧化物对应水化物的pH=1 | |
| D. | X、Y、Z的气态氢化物稳定性依次增强,沸点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
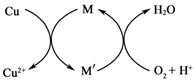
| A. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| D. | “酸坏之酒皆可蒸烧,复烧二次价值数倍也”.该方法也可以分离乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的简单阴离子半径一定大于Z的简单阳离子半径 | |
| B. | 最简单氢化物的稳定性:X-定强于Y | |
| C. | Y单质分子的电子式-定为 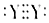 | |
| D. | X、W形成化合物的水溶液必须保存在带玻璃塞的细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO是具有刺激性的红棕色气体 | |
| B. | SO3溶于水生成亚硫酸 | |
| C. | 向品红溶液中通入二氧化硫气体,溶液褪色,加热后溶液又会出现红色 | |
| D. | 氨水中滴入酚酞溶液,颜色变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
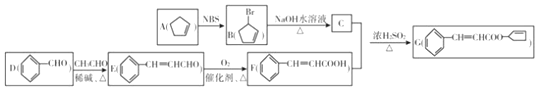
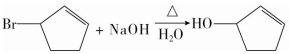 ,其反应类型为取代反应(或水解反应).
,其反应类型为取代反应(或水解反应).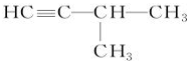 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化学上常用AG表示溶液中的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.25℃时,用0.100mol•L-1的NaOH溶液滴定20.00mL 0.100mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
化学上常用AG表示溶液中的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.25℃时,用0.100mol•L-1的NaOH溶液滴定20.00mL 0.100mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A. | D点溶液的pH=11.25 | |
| B. | B点溶液中存在 c(H+ )-c(OH- )=c(NO2- )-c(HNO2) | |
| C. | C点时,加入NaOH溶液的体积为20 mL | |
| D. | 25℃时,HNO2的电离常数Ka=1.0×10-55 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com