
| A. | AlCl3和 NaOH | B. | NaHSO4和Ba(OH)2 | C. | NaAlO2和 H2SO4 | D. | Na2CO3和盐酸 |
分析 A、当AlCl3少量时,氯化铝和NaOH溶液反应生成偏铝酸钠,当AlCl3过量时,二者反应生成氢氧化铝沉淀;
B、只发生NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O;
C、偏铝酸钠和少量H2SO4反应生成氢氧化铝沉淀,和过量H2SO4反应生成硫酸铝;
D、前者逐滴滴入后者,发生Na2CO3+2HCl═2NaCl+CO2↑+H2O,后者逐滴滴入前者发生Na2CO3+HCl═NaHCO3+NaCl、NaHCO3+HCl═NaCl+CO2↑+H2O.
解答 解:A、当AlCl3少量时,氯化铝和NaOH溶液反应生成偏铝酸钠,当AlCl3过量时,二者反应生成氢氧化铝沉淀,所以反应现象不同,故A不选;
B、无论前者逐滴滴入后者,还是后者逐滴滴入前者,都发生NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,现象相同,故B选;
C、偏铝酸钠和少量H2SO4反应生成氢氧化铝沉淀,和过量H2SO4反应生成硫酸铝,所以反应现象不同,故C不选;
D、前者逐滴滴入后者,发生Na2CO3+2HCl═2NaCl+CO2↑+H2O,立即看到气泡,后者逐滴滴入前者发生Na2CO3+HCl═NaHCO3+NaCl、NaHCO3+HCl═NaCl+CO2↑+H2O,现象为开始没有气泡冒出,一段时间后有气泡冒出,则现象不同,故D不选;
故选B.
点评 本题考查利用滴加顺序不同来判断反应的现象,明确发生的化学反应是解答本题的关键,难度不大.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 比较非金属性强弱:Si弱于C,C弱于S | |
| B. | 用四氯化碳提取碘水中的碘单质 | |
| C. | 观察烧碱的焰色反应 | |
| D. | 比较NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.2}{{t}_{1}}$mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=0.32 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )| A. | 氢铝化合物可能成为未来的燃料 | |
| B. | Al2H6中含有非极性键 | |
| C. | Al2H6是分子晶体 | |
| D. | Al2H6与水反应生成氢氧化铝和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molN2所含有的原子数为NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | Na2O2和CO2的反应中,每有1molNa2O2参加反应转移电子数为2NA | |
| D. | 16 gO2分子和16 gO3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
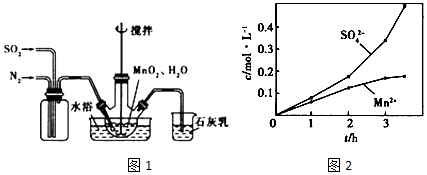
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com