
| A. | +46 kJ/mol | B. | +92kJ/mol | C. | -46 kJ/mol | D. | -92 kJ/mol |
分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据反应热=反应物的总键能-生成物的总键能计算N2(g)+3H2(g)═2NH3(g)的△H.
解答 解:已知:H-H键能为436kJ•mol-1,H-N键能为391kJ•mol-1,N≡N键的键能946kJ•mol-1,
反应N2(g)+3H2(g)=2NH3(g)的焓变△H=反应物的总键能-生成物的总键能=946kJ•mol-1+436kJ•mol-1×3-391kJ•mol-1×6=-92kJ•mol-1,
故选D.
点评 本题考查反应热的计算,题目难度不大,明确“焓变△H=反应物的总键能-生成物的总键能”为解答关键,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1
磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
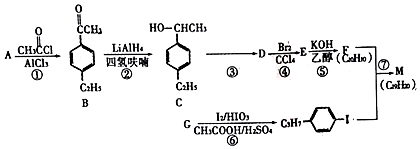
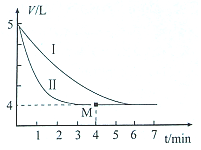
 +H≡C-H→
+H≡C-H→ =C+H,回答下列问题:
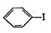
=C+H,回答下列问题: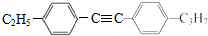 ,A的名称为乙苯.
,A的名称为乙苯. .
.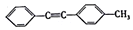 的合成路线:
的合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的一种单质具有良好的导电性 | |
| B. | 氧化物对应水化物的酸性:D>A | |
| C. | B、C的单质均可与NaOH溶液反应生成氢气 | |
| D. | A、B、C三种元素均可以与D元素形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 青蒿素分子式为C15H2405 | |
| B. | 反应②原子利用率为100% | |
| C. | 该过程中青蒿素生成双氢青蒿素属于氧化反应 | |
| D. | 1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
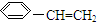 )的叙述错误的是( )
)的叙述错误的是( )| A. | 可以和溴水反应 | |
| B. | 分子中所有原子可能共面 | |
| C. | 是苯的同系物 | |
| D. | 1mol苯乙烯可以和4mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
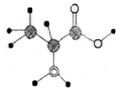 如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )
如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )| A. | 分子式为C3H7O2N | |
| B. | 该分子不能与碳酸钠发生反应 | |
| C. | 该分子可以与盐酸发生反应 | |
| D. | 该分子在一定条件下可以反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com