
| A. | 在上述溶液中加入少量的NaOH或HCl溶液时,溶液的pH有可能不会发生显著变化 | |
| B. | 溶液中四种离子之间有可能满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 当溶液中溶质为CH3COONa和NaOH时,则一定有c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 当四种离子之间能满足c(CH3COO-)>c(Na+)>c(H+)>c(OH)时,则溶液中溶质一定是CH3COONa和CH3COOH |
分析 A.若是醋酸钠和醋酸的混合液,为缓冲溶液,加入少量的氢氧化钠或盐酸,溶液的pH变化不大;
B.溶质为醋酸钠时,醋酸根离子部分水解,则c(Na+)>c(CH3COO-)、c(OH-)>c(H+);
C.如果醋酸钠的物质的量远远大于氢氧化钠,则会出现c(CH3COO-)>c(OH-);
D.当四种离子之间能满足c(CH3COO-)>c(Na+)>c(H+)>c(OH)时,溶液显示酸性,则溶液中一定存在醋酸,还一定存在醋酸钠.
解答 解:A.该溶液可能为醋酸和醋酸钠的混合液,该溶液为缓冲溶液,则向该溶液中加入少量的NaOH或HCl溶液时,溶液的pH有可能不会发生显著变化,故A正确;
B.当溶液中的溶质为醋酸钠时,由于醋酸根离子部分水解,溶液显示碱性,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-),由于水解程度较小,则离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B正确;
C.当溶液中溶质为CH3COONa和NaOH时,如果醋酸钠的物质的量远远大于NaOH,则c(CH3COO-)>c(OH-),此时溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.当四种离子之间能满足c(CH3COO-)>c(Na+)>c(H+)>c(OH)时,溶液显示酸性,由于醋酸钠溶液显示碱性,若要满足溶液显示酸性,则溶质中一定存在醋酸,再结合质量守恒,溶液中还一定存在醋酸钠,即:溶液中溶质一定是CH3COONa和CH3COOH,故D正确;
故选C.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力及逻辑推理能力,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:解答题

 (或
(或
 );
);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 选项 | X | Y |
| A | Na2CO3 | NaHCO3 |
| B | Al(OH)3 | Al2O3 |
| C | FeCl3 | FeCl2 |
| D | CuSO4 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
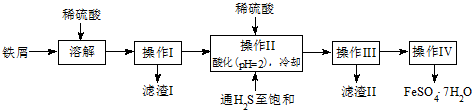
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
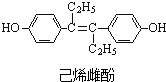
| A. | 与NaOH反应可生成化学式为C18H18O2Na2的化合物 | |
| B. | 聚己烯雌酚含有顺式和反式两种结构 | |
| C. | 1mol己烯雌酚最多可与7molH2发生加成反应 | |
| D. | 形成高分子 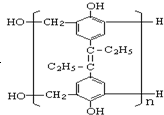 的单体中有己烯雌酚 的单体中有己烯雌酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 向煤中加入适量石灰石,在煤燃烧时SO2最终生成CaSO4,可减少对大气的污染 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 食物溶于水后的溶液 pH<7,则该食物为成酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(H+)+c(Cl-)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Na+>O2->H+ | B. | 与水反应的剧烈程度:K>Na>Mg>Ca | ||
| C. | 熔点:CO2>SiO2>Na2O>SO3 | D. | 还原性:PH3>H2S>HCl>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
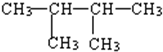 ③
③ ④
④
| A. | ①>②>③>④ | B. | ③=①>②>④ | C. | ③>②>④>① | D. | ②>③=①>④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com