
【题目】设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.标准状况下,1L庚烷所含有的分子数为 ![]()
B.1mol甲基(﹣CH3)所含电子数为9NA
C.标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数为16NA
D.26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA
科目:高中化学 来源: 题型:
【题目】草酸是二元弱酸,草酸氢钾溶液呈酸性.在0.1molL﹣1 KHC2O4溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(HC2O ![]() )+c(OH﹣)+c(C2O
)+c(OH﹣)+c(C2O ![]() )
)
B.c(HC2O ![]() )+c(C2O
)+c(C2O ![]() )=0.1 mol?L﹣1
)=0.1 mol?L﹣1
C.c(C2O ![]() )<c(H2C2O4)
)<c(H2C2O4)
D.c(K+)=c(H2C2O4)+c(HC2O ![]() )+c(C2O
)+c(C2O ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据填空: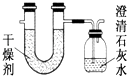
(1)实验完毕后,生成物中水的质量为g,假设广口瓶里生成一种正盐,其质量为g.
(2)生成的水中氢元素的质量为g.
(3)生成的CO2中碳元素的质量为g.
(4)该燃料中碳、氢元素质量比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气制成漂白粉的主要目的是( )
①使它转变成易溶于水的物质 ②使它转变成稳定、便于储存的物质 ③提高氯的质量分数 ④提高漂白能力
A.①②④B.③④C.②③D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:方案Ⅰ
①称取碳酸钙样品M g
②用c1mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL.
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1g.
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的公式为 .
(2)方案Ⅱ中的“冷却”应如何操作?;理由是 .
(3)方案Ⅲ中不需要的数据是 (填选项编号).
A.c、V
B.c1、V1
C.M1
D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是 (填选项编号).
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于研究物质性质的基本程序:①观察物质的外观性质;②实验并观察现象;③解释现象及得出结论;④预测物质的性质。排序正确的是( )
A.②①③④B.①②③④
C.①④②③D.④①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是8种有机化合物的转换关系: 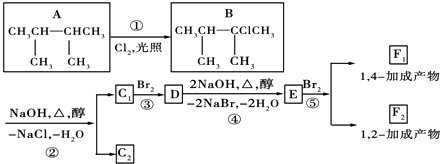
请回答下列问题:
(1)根据系统命名法,化合物A的名称是 .
(2)上述框图中,①是反应,③是反应(填反应类型).
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式: .
(4)C1的结构简式是;F1的结构简式是 . F1与F2的关系为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据题目要求完成下列各题:
(1)少量的NaHCO3与Ca(OH)2反应的离子反应方程式____________。
(2)用双线桥标出方程式2KMnO4=K2MnO4 + MnO2 + O2中电子转移的方向和数目______________。
(3)用双线桥标出方程式6HCl + KClO3= KCl +3Cl2 +3H2O 中电子转移的方向和数目_______,并指出氧化产物与还原产物的物质的量的比___________。
(4)在MnO2+4HCl=MnCl2+Cl2+2H2O中氧化剂与还原剂的物质的量的比_______,当0.4molHCl被氧化时,则生成标准状况下的Cl2的体积为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com