
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO2 | H2 | |||
| A | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| B | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| △c |
| △t |
| m |
| V |
| △c |
| △t |
| ||
| 5min |
 CO2(g)+H2(g)
CO2(g)+H2(g)| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| 0.2×0.2 |
| 0.3×0.8 |
| 1.6mol |
| 4mol |
| 0.4mol |
| 2mol |


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
| A、同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
| B、同pH时,三种溶液稀释相同倍数后,pH:a<b<c |
| C、同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c |
| D、同物质的量浓度的三种溶液的pH:a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
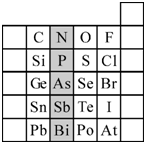 元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:
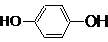
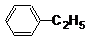
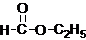
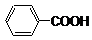
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
||||||||
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
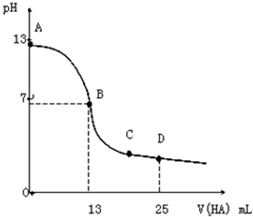 常温下,向25mL 0.1mol?L-1 MOH 溶液中逐滴加入0.2mol?L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol?L-1 MOH 溶液中逐滴加入0.2mol?L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气溶于水:H2O+Cl2=2H++ClO-+Cl- |
| B、将铝粉投入氢氧化钠溶液中:2Al+2OH-=2AlO2-+H2 |
| C、铜与氯化铁溶液反应:Cu+Fe3+=Fe2++Cu2+ |
| D、过氧化钠与水反应:2Na2O2+2H20=4Na++4OH-+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com