
| A. | 氯水应该盛放在棕色的广口瓶中 | |
| B. | 某溶液中加入CCl4后显紫色,证明溶液中有I- | |
| C. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 | |
| D. | 某溶液中滴加BaCl2溶液后有白色沉淀生成,加入稀盐酸后沉淀不消失,则该溶液中可能有Ag+或SO42- |
分析 A.溶液应放在细口瓶中;
B.碘的四氯化碳溶液为紫色;
C.能使湿润的淀粉碘化钾试纸变蓝的气体具有氧化性,可生成碘离子生成碘;
D.滴加BaCl2溶液后有白色沉淀生成,可能生成氯化银或硫酸钡沉淀.
解答 解:A.氯水为氯气的水溶液,应放在细口瓶中,故A错误;
B.碘的四氯化碳溶液为紫色,说明含有碘单质,而不是碘离子,故B错误;
C.能使湿润的淀粉碘化钾试纸变蓝的气体具有氧化性,可生成碘离子生成碘,不一定为氯气,故C错误;
D.滴加BaCl2溶液后有白色沉淀生成,可能生成氯化银或硫酸钡沉淀,则该溶液中可能有Ag+或SO42-,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及相关化学实验的基本操作,难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:实验题
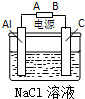 甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.
甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.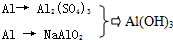
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
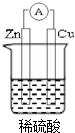 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2OH | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | CH4$\stackrel{高温}{→}$C+2H2 | D. | CH≡CH+HCl$→_{△}^{催化剂}$CH2═CHCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
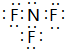 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com