
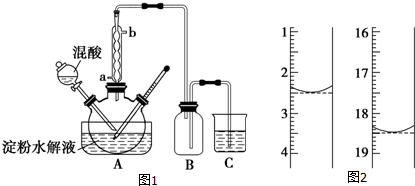
���� ��1��Ũ���������ˮ�Ժʹ����������������������ɲ��ᣬͨ��Ũ������ˮˮ�ִٽ�������Ӧ�����ƶ���
��2������������Һ����ɫ�����Կ����õ�ˮ������ۣ�
��3�������ܵ������������������������������ã���������ˮ������Ϊ������
��4���л�������װ���ܷ�ֹ������
��5������Ũ�ȹ��ᵼ��������������������ǣ�C6H12O6��������ΪCO2����H2C2O4��һ����������
��6���ŵ㣺���HNO3�����ʣ���ѭ��ʹ�õ�������� ȱ�㣺NOx������������ղ���ȫ��
��7���������Ϊ�Ϻ�ɫ�������в���Ҫ��ָʾ���������������£�������������ܺͲ��ᷢ��������ԭ��Ӧ���ɶ��������ӡ�������̼��ˮ�����ݷ�Ӧ���㣮
��� �⣺��1��Ũ�������ǿ�����ԡ���ˮ�Ժ���ˮ�ԣ�����ʵ���ǽ�C6H12O6���������������Ʊ����ᣬŨ������������Ũ������ˮ�����������ɲ���ķ����ƶ�������Ũ����������Ǽӿ����ˮ������ʣ������������ã���
�ʴ�Ϊ���ӿ����ˮ������ʣ������������ã���
��2�������������ɫ�����Ѿ�ˮ��ĵ�����Һ�еμӼ��ε�Һ����Һ����ɫ����֤������û����ȫˮ�⣻��Һ������ɫ����֤��������ȫˮ�⣬
�ʴ�Ϊ����ˮ��
��3�����ܵ������������������������������ã�����Ч������Ч���ã�����ˮ�Ľ�����a��b�����ʴ�Ϊ��a��
��4��װ��B�������Ƿ�ֹ����װ�ú�����װ�ü䷢����������ȫƿ�����ã��ʴ�Ϊ������ȫƿ��
��5������Ϊ65%HNO3��98%H2SO4�Ļ��Һ�����Һ����ˮ���ȣ��¶ȸ��ܼӿ컯ѧ��Ӧ�������ܽ�һ������H2C2O4�ɶ�����̼��
�ʴ�Ϊ���¶ȹ��ߣ�����Ũ�ȹ�����H2C2O4��һ����������
��6���ú������ĸҺ�����յ������������������ظ�ʹ�ã����HNO3�����ʣ���Ҳ��������ղ���֣���ɻ�����Ⱦ��
�ʴ�Ϊ�����HNO3�����ʣ�NOx������������ղ���ȫ��
��7�����������ҺΪ�Ϻ�ɫ�����ﵽ�ζ��յ�ʱ���ٵ�����������Һʱ������ɫ������ȥ�������ƣ�Na2C2O4������ϡ�����У�Ȼ�������Ը��������Һ���еζ������ӷ���ʽΪ2MnO4-+5C2O42-+16H+=2Mn2++10CO2��+8H2O��ͼʾ�ζ���������Һ���=18.50mL-2.50mL=16.00mL��
n��KMnO4��=0.016L��0.0200mol•L-1=3.2��10-4mol�����ݷ���ʽ�ɵã�
2MnO4-+5C2O42-+16H+=2Mn2++10CO2��+8H2O
2 5
3.2��10-4mol 8��10-4mol
��Ʒ�ж�ˮ�ϲ��������Ϊm=8��10-4mol��126g/mol=8��126��10-4g=0.1008g��
��ò��ᾧ����Ʒ�ж�ˮ�ϲ������������Ϊ$\frac{0.1008g}{0.12g}$��100%=84.0%��
�ʴ�Ϊ��84.0%��
���� ���⿼���˲������ȡ��Ϊ��Ƶ���㣬�漰�����Ʊ���������ԭ��Ӧ�ζ���֪ʶ�㣬����ʵ���ԭ����ʵ�������������������������ԭ�����ǽ��Ĺؼ���ע������������ã���Ŀ�Ѷ��еȣ�


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д� ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ��Һ�ܵ��磬���������ǵ���� | |
| B�� | �����������Ư���ԣ�Һ�Ⱦ��м�ǿ��Ư���� | |
| C�� | ������ʹ��ɫʯ����Һ�ȱ�����ɫ | |
| D�� | ͭ��������ȼ�����ɺ���ɫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֻҪ�������������ʣ�Һ����c��NH4+ �����ǵ���c��NH2- �� | |
| B�� | һ���¶��£�c��NH4+ ����c��NH2- ��Ϊ���� | |
| C�� | �����������䣬����Һ������������ƽ�������ƶ� | |
| D�� | ά���¶Ȳ��䣬��Һ���м��������Ȼ�粒��壬c��NH2-�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪X��Y��Z����Ԫ�ص�ԭ������֮�͵���48��X���л�����Ҫ���Ԫ�أ�X��һ��1��1����̬�⻯������м��ЦҼ����Цм���Z�ǽ���Ԫ�أ�Z�ĺ˵����С��28���Ҵ������2��δ�ɶԵ��ӣ�
��֪X��Y��Z����Ԫ�ص�ԭ������֮�͵���48��X���л�����Ҫ���Ԫ�أ�X��һ��1��1����̬�⻯������м��ЦҼ����Цм���Z�ǽ���Ԫ�أ�Z�ĺ˵����С��28���Ҵ������2��δ�ɶԵ��ӣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ֿ����ڱ��溣�ʲ�Ʒ | |
| B�� | �轺��������ǿ�����������������ʳƷ����� | |
| C�� | ��ҵ������Cl2�����ʯ��ˮ��Ӧ��ȡƯ�� | |
| D�� | ��Ȼ��ά�ͺϳ���ά����Ҫ�ɷ�����ά�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaCl | B�� | CO2 | C�� | C12H22O11�����ǣ� | D�� | Al |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����������������Ҫ�����ǣ�
�����������������Ҫ�����ǣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com