
【题目】金属锰在冶金工业中用来制造特种钢,常作为脱硫剂和去氧剂,其化合物广泛应用于电池、机械制造业等领域。
(1)以软锰矿(主要为MnO2)为原料通过热还原法得到金属锰涉及的两个反应:
①3MnO2(s)=Mn3O4(s)+ O2(g) △H1= akJmol-1
②3Mn3O4(s)+ 8Al(s) =4Al2O3(s) + 9Mn(s) △H2= bkJmol-1
已知Al的燃烧热为 △H3=ckJmol-1,则MnO2与Al发生铝热反应的热化学方程式为___________。
(2)科研人员将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液 体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
请回答下列问题:
①为加快反应速率可以采取的措施有__________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________________。
②下列能说明反应已达平衡的有____________________(填编号)。
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
③室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,Mn2+的产率为____________。
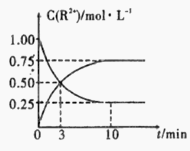
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则 再次平衡时c(Mn2+) =____________(不考虑离子水解的影响)。
(3)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为_____________________,阳极附近溶液的pH____________(选填“增大”、“减小”或“不变”)。
【答案】![]() 升高温度或增大c(Sn2+) 构成多个微型原电池,加快反应速率 ACD 3 75% 0.375molL-1
升高温度或增大c(Sn2+) 构成多个微型原电池,加快反应速率 ACD 3 75% 0.375molL-1 ![]() 减小
减小
【解析】
(1)Al的燃烧热为 △H3=ckJmol-1,则铝的燃烧反应的热化学方程式为:③![]() ,根据盖斯定律计算(①×3+②+③)×
,根据盖斯定律计算(①×3+②+③)×![]() 得到MnO2与Al发生铝热反应的热化学方程式:
得到MnO2与Al发生铝热反应的热化学方程式:![]() ;
;
(2)①通过升高温度或增大反应物浓度可使化学反应速率加快;因Mn与Sn的金属活泼性不同,析出的Sn附着在Mn表面,溶液中存在能够自由移动的离子,从而构成了原电池,使得Mn的溶解速率加快,故答案为:升高温度或增大c(Sn2+);构成多个微型原电池,加快反应速率;
②A.该体系中只有Sn2+具有颜色,若溶液的颜色不发生变化,则说明溶液中c(Sn2+)不变,能够说明反应达到了平衡状态,故A符合题意;
B.因不确定起始Sn2+浓度以及其转化率,因此达到平衡状态时,无法确定c(Mn2+)与c(Sn2+)关系,故不能判断反应是否处于平衡状态,故B不符合题意;
C.反应中固体质量在不断发生变化,若体系中固体的质量不变,说明溶液中离子浓度不变,能够说明反应达到平衡状态,故C符合题意;
D.随着反应的进行,Mn2+与Sn2+浓度在不断变化,当Mn2+与Sn2+浓度的比值保持不变时,说明正逆反应速率相同,反应达到平衡状态,故D符合题意;
故答案为:ACD;
③随着反应的进行,c(Sn2+)逐渐减小,c(Mn2+)逐渐增加,由此可知,平衡状态下c(Mn2+)=0.75mol/L,c(Sn2+)=0.25mol/L,平衡常数 ;Mn2+理论产量为Sn2+完全转化时的生成量,由此Mn2+的产量为
;Mn2+理论产量为Sn2+完全转化时的生成量,由此Mn2+的产量为![]() ;
;
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,c(Mn2+)、c(Sn2+)均变为原来的一半,平衡不发生移动,由此再次平衡时![]() ;
;
(3)由题可知,该体系中Mn元素化合价升高,电解质溶液为酸性,由此阳极上发生的电极反应式为:![]() ;阳极附近生成了H+,溶液的pH将减小。
;阳极附近生成了H+,溶液的pH将减小。


科目:高中化学 来源: 题型:
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:

回答下列问题:
(1)A是:____________, I是:____________(填化学式);
(2)按要求写出下列反应的方程式:
Ⅰ.①的化学方程式:______________________________;
Ⅱ.②的化学方程式(同时用双线桥法表示该反应的电子转移情况):________________;
Ⅲ. J与过量的澄清石灰水反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)5.4 g H2O的物质的量是_____,含有_________个水分子(用NA表示),含有____mol H。
(2)11.2L NH3(标况)约含_____ mol氢原子,_____ g的氮原子。
(3)6.02×1022个OH 的质量为____,含有质子的物质的量为_____,含有电子的物质的量为__ 。
(4)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为_______,R的相对原子质量为_______。含R的质量为1.6 g的Na2R,其物质的量为________。
(5)物质的量相同的CO2和O2,其所含原子数目之比为_____,所含氧原子数目之比为______;质量相同的CO2和O2,其物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O42H2O)的工业流程如图。已知:①草酸钴晶体难溶于水,②RH为有机物(难电离)
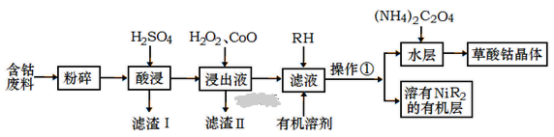
(1)滤渣I的主要成分是_____________(填化学式) ,写出两种能提高酸浸速率的措施_____________ 、 ___________。
(2) 操作①用到的主要仪器有___________________。
(3) H2O2是种绿色氧化剂,写出加入H2O2后发生反应的离子方程式________________________________________。
(4)加入氧化钴的目的是______________________________。
(5)加入(NH4)2C2O4反应得到草酸钴晶体的离子方程式________________________________,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是__________________________________________。
(6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-) ,测定溶液中C2O42-的浓度, KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果___________(填“偏高”、“偏低“或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量的铝铁合金与1000mL一定浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4.00mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)原混合物中铝粉与铁粉的物质的量之比为______
(2)硝酸溶液的物质的量浓度为______molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。

已知:
![]()
CH3CH2Cl![]() CH3CH2CNCH3CH2COOH
CH3CH2CNCH3CH2COOH
(1)下列说法正确的是______
A.化合物A能与FeCl3溶液发生显色反应B.化合物E具有弱碱性
C.化合物X能发生加成、取代、还原反应
D.化合物Y的分子式为C20H23NO4
(2)化合物C的结构简式______
(3)写出D+E→X的化学反应方程式______
(4)写出同时符合下列条件的B的同分异构体的结构简式______
1H-NMR谱和IR谱检测表明:
①分子中有4种化学环境不同的氢原子;
②分子中含有苯环、甲氧基(-OCH3),-CH2Cl
(5)请设计以苯和乙烯为原料制备 的合成路线(用流程图表示,无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH3CHOCH3COOH______________
的合成路线(用流程图表示,无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH3CHOCH3COOH______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液490mL。根据溶液的配制情况回答下列问题。
(1)配制上述溶液需要的玻璃仪器有烧杯、玻璃棒、量筒、__________、__________。
(2)配制时,正确的操作顺序是(用字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶液
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于__________、后用于__________。
(4)报据计算用托盘天平称取NaOH固体的质量为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)无机化合物可根据其组成和性质进行分类:
ⅰ、下图所示的物质分类方法名称是________。

ⅱ、以Na、K、H、O、C、S中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ② __ | ③ __ ④ Ba(OH)2 | ⑤ Na2CO3 ⑥ ___ | ⑦ CO2 ⑧ H2O |
ⅲ、 写出⑦通入到过量的④溶液中的离子方程式:_________。
ⅳ、 实验室检验气态⑧的方法是___________。
(2)某无色透明溶液,跟金属铝反应放出H2,判断下列离子:Mg2+、Ba2+、Cu2+、H+、Ag+、SO42-、SO32-、OH-、HCO3-、NO3-,哪种离子能大量存在于此溶液中。
ⅰ、 生成Al3+时,原无色透明溶液能够大量存在的离子有_______。
ⅱ、生成AlO2-时,原无色透明溶液能够大量存在的离子有_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com