
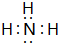 .e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为
.e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为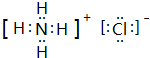 .
.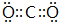 .z单质的电子式为
.z单质的电子式为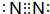 ,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为
,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为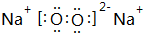 .用电子式表示x和d原子个数为1:1的化合物的形成过程
.用电子式表示x和d原子个数为1:1的化合物的形成过程 .
.分析 八种短周期主族元素(用字母x、y、z、d、e、f、g、h表示)原子序数依次递增.d是地壳中含量最高的元素,则d为O元素;x的最高正化合价和最低负化合价的代数和为零,y的一种单质具有很高的硬度和熔点,二者原子序数小于氧,故x为H元素、y为C元素,z的原子序数介于碳、氧之间,故z为N元素;z、e、f的最高价氧化物对应的水化物可两两反应,应是氢氧化铝、强碱、强酸之间的反应,则e为Na、f为Al;化学上常用品红溶液来鉴别g的一种氧化,则g为S,可推知h为Cl.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)e与z形成的化合物Na3N,与水作用可产生一种有刺激性气味的10电子气体i,则i为NH3.Na3N与盐酸反应生成NH4Cl、NaCl,其中热稳定性最差的为NH4Cl,由铵根离子与氯离子构成;
(3)电子层结构相同的离子,核电荷数越大离子半径越小;非金属性越强,最高价氧化物对应的水化物的酸性;
(4)y在过量的d中反应生成物为CO2,分子中碳原子与氧原子之间形成2对共用电子对;z单质为N2,分子中N原子之间形成3对共用电子对;e和d形成原子个数为1:1的化合物为Na2O2,由钠离子与过氧根离子构成;x和d原子个数为1:1的化合物为H2O2,属于共价化合物;
(5)①R是NH4Al(SO4)2,根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42-)、n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量;
(6)①假设KAl(SO4)2的物质的量为1mol,则明矾溶液中含有2mol SO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子完全沉淀时生成1mol氢氧化铝,1.5mol硫酸钡,再滴加氢氧化钡,有1mol硫酸钡沉淀时,会溶解2mol氢氧化铝,故铝离子恰好沉淀时生成沉淀物质的量最大;
②生成1mol硫酸钡的质量为233g,溶解2mol氢氧化铝的质量为156g,故SO42-刚好沉淀完全时固体质量最大.
解答 解:八种短周期主族元素(用字母x、y、z、d、e、f、g、h表示)原子序数依次递增.d是地壳中含量最高的元素,则d为O元素;x的最高正化合价和最低负化合价的代数和为零,y的一种单质具有很高的硬度和熔点,二者原子序数小于氧,故x为H元素、y为C元素,z的原子序数介于碳、氧之间,故z为N元素;z、e、f的最高价氧化物对应的水化物可两两反应,应是氢氧化铝、强碱、强酸之间的反应,则e为Na、f为Al;化学上常用品红溶液来鉴别g的一种氧化,则g为S,可推知h为Cl.
(1)h为Cl,处于周期表中第三周期VIIA族,故答案为:第三周期VIIA族;
(2)e与z形成的化合物Na3N,与水作用可产生一种有刺激性气味的10电子气体i,则i为NH3,其电子式为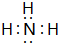 ,Na3N与盐酸反应生成NH4Cl、NaCl,其中热稳定性最差的为NH4Cl,由铵根离子与氯离子构成,电子式为
,Na3N与盐酸反应生成NH4Cl、NaCl,其中热稳定性最差的为NH4Cl,由铵根离子与氯离子构成,电子式为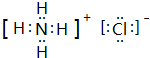 ,
,
故答案为: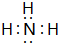 ;2;
;2;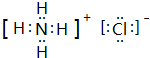 ;
;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:N3->Na+;非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4,
故答案为:N3->Na+;HClO4>H2SO4;
(4)y在过量的d中反应生成物为CO2,电子式为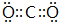 ;z单质为N2,分子中N原子之间形成3对共用电子对,电子式为
;z单质为N2,分子中N原子之间形成3对共用电子对,电子式为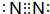 ,结构式为N≡N;e和d形成原子个数为1:1的化合物为Na2O2,由钠离子与过氧根离子构成,电子式为
,结构式为N≡N;e和d形成原子个数为1:1的化合物为Na2O2,由钠离子与过氧根离子构成,电子式为 ;x和d原子个数为1:1的化合物为H2O2,属于共价化合物,用电子式表示形成过程为
;x和d原子个数为1:1的化合物为H2O2,属于共价化合物,用电子式表示形成过程为 ,
,
故答案为: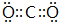 ;
;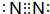 ;N≡N;
;N≡N; ;
; ;
;
(5)10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022;
(6)①假设KAl(SO4)2的物质的量为1mol,则明矾溶液中含有2mol SO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子完全沉淀时生成1mol氢氧化铝,1.5mol硫酸钡,再滴加氢氧化钡,有1mol硫酸钡沉淀时,会溶解2mol氢氧化铝,故铝离子恰好沉淀时生成沉淀物质的量最大,反应离子方程式为:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓;
故答案为:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓;
②生成1mol硫酸钡的质量为233g,溶解2mol氢氧化铝的质量为156g,故SO42-刚好沉淀完全时固体质量最大,SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,
故答案为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.
点评 本题考查结构位置性质关系、离子半径的大小比较、元素周期律、电子式、化学计算、离子方程式书写等,是对学生综合能力的考查,需要学生具备扎实的基础,难度较大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下反应 |
| B | 将可调高度的铜丝伸入到HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| C | 将浓硫酸滴到蔗糖表面 | 固体变黑 | 浓硫酸具有脱水性和强酸性 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的H2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
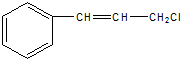 中官能团的名称:碳碳双键、氯原子.
中官能团的名称:碳碳双键、氯原子.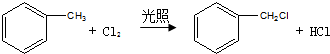 .
.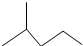 所表示物质的名称是:2-甲基戊烷.
所表示物质的名称是:2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
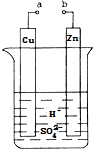 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应,再向反应后溶液中滴 加酚酞. | A.产生白烟 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色.与酸反应剧烈,产生大量气泡且可以燃烧 |
| 3.镁带用砂纸打磨后在空气中燃烧 | C.产生大量气泡、气体可以燃烧 |
| 4.NaI溶液中加入溴水和CCl4 | D.下层溶液变橙色 |
| 5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞.镁带用砂纸打磨后与2mol/L盐酸反应. | E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
| 6.蘸浓氨水与浓盐酸的两玻璃棒接近 | F.下层溶液变紫色 |
| 7.NaBr溶液中加入氯水和CCl4 | G.发出耀眼的强光,生成白色物质 |
| 8.铝片用砂纸打磨后与2mol/L盐酸反应 | H.生成淡黄色沉淀 |
| 探究同一周期从左到右元素 金属性的递变规律 | 探究同一主族内从上到下元素 非金属性的递变规律 | |||||||
| Ⅰ | ||||||||
| Ⅱ | ||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.02mol•L-1 | D. | 20 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com