称取0.200克某赤铁矿样品,矿样溶解后,使其中的铁全部转化成Fe2+(所得溶液中不含其他还原性物质).另称7.90克硫酸铈.2(NH4)2SO4?Ce(SO4)2?2H2O (摩尔质量为632克/摩尔),溶解后稀释至250毫升.取该溶液30.0毫升恰好与上述Fe2+溶液完全反应.反应的离子方程式为:Ce4++Fe2+=Ce3++Fe3+.请计算该矿样中Fe2O3的质量百分含量)(Fe2O3摩尔质量为160克/摩尔).
解:由7.90克硫酸铈.2(NH
4)
2SO
4?Ce(SO
4)
2?2H
2O (摩尔质量为632克/摩尔),
则硫酸铈的物质的量为

=0.0125mol,
Ce
4+的物质的量浓度为
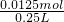
=0.05mol/L,
由反应的离子方程式为Ce
4++Fe
2+=Ce
3++Fe
3+,
则Fe
2+的物质的量为0.05mol/L×0.03L=0.0015mol,
由铁元素守恒可知Fe
2O
3的物质的量0.0015mol×

=0.00075mol,
该矿样中Fe
2O
3的质量百分含量为

×100%=60%,
答:该矿样中Fe
2O
3的质量百分含量为60%.
分析:根据质量与摩尔质量来计算硫酸铈的物质的量,再利用Ce
4++Fe
2+=Ce
3++Fe
3+来计算Fe
2+的物质的量,由铁元素守恒可知Fe
2O
3的物质的量,最后计算该矿样中Fe
2O
3的质量百分含量.
点评:本题考查学生利用物质的质量与摩尔质量及离子反应进行的简单计算,明确物质的量计算的基本公式及铁元素的质量守恒是解答本题的关键.

 =0.0125mol,
=0.0125mol,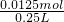 =0.05mol/L,
=0.05mol/L, =0.00075mol,
=0.00075mol, ×100%=60%,
×100%=60%,
