
��һ�������ȵĹ̶��ݻ����ܱ������У�
 �������淴ӦmA(g) + nB(g) pC(g) + qD(g)��m��n��p��qΪ��������ʱ���ﵽƽ��ı�־�ǣ�
�������淴ӦmA(g) + nB(g) pC(g) + qD(g)��m��n��p��qΪ��������ʱ���ﵽƽ��ı�־�ǣ�
����ϵ��ѹǿ���ٸı� ����ϵ�¶Ȳ��ٸı�
�۸���ֵ�Ũ�Ȳ��ٸı� �ܸ���ֵ������������ٸı�
�ݷ�Ӧ����vA��vB��vC��vD=m��n��p��q
��λʱ����m mol A�ϼ���Ӧ��ͬʱp mol CҲ�ϼ���Ӧ
A���ۢܢݢ� B���ڢۢܢ� C���٢ۢܢ� D���٢ۢܢ�
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ԫ����ָ������������������0.01%���µ�Ԫ�أ���ЩԪ�ض������
 ���������ͽ���������Ҫ���ã����и���Ԫ��ȫ������Ԫ�ص���( )
���������ͽ���������Ҫ���ã����и���Ԫ��ȫ������Ԫ�ص���( )
 A��Na��K��Cl��S��O B��N��H��O��P��C
A��Na��K��Cl��S��O B��N��H��O��P��C
 C��F��I��Fe��Zn��Cu D��Ge��Se��Cu��Mg��C
C��F��I��Fe��Zn��Cu D��Ge��Se��Cu��Mg��C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�Ũ������������ƻ�ͷų��������˵���в���ȷ���� �� ��
A���������Ӵ���ת��ΪSO3 B����������ܽ�������ˮ��Һ��
C�����ܶȱȿ���С���Ҳ���Һ�� D����ˮ��Һ�����ԣ����ܱ�ǿ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʵ���Ũ��Ϊ18.4 mol/L��Ũ����20.0 mL������ͭм����һ��ʱ�����ȴ����ȥ�����ͭм������Һ��ˮ��100.0 mL�������Һ��SO42-�����ʵ���Ũ��Ϊ3.18 mol/L�������100 mL��Һ������ͭ�����ʵ���Ũ�ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�¶�ʱ��Ũ�ȶ���1 mol��L-1���������壬X2��Y2���ܱ������з�Ӧ��������Z���ﵽƽ��ʱc(X2)Ϊ0.4 mol��L-1��c(Y2)Ϊ0.8 mol��L-1������c(Z)Ϊ0.4 mol��L-1����÷�Ӧ�ķ�Ӧʽ��
A��X2+2Y2 2XY2������������B��2X2+Y2 2X2Y
C��3X2+Y2 2X3Y������������D��X2+3Y2 2XY3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ӧ�ٶ�v�ͷ�Ӧ��Ũ��c�Ĺ�ϵ����ʵ�鷽���ⶨ�ġ�
��ѧ��ӦH2+Cl2��2HCl�ķ�Ӧ����v�ɱ�ʾΪv=K( )m(
)m( )nʽ��KΪ������m��nֵ�����±�������ȷ����
)nʽ��KΪ������m��nֵ�����±�������ȷ����
|
|
| v (mol��L-1��s-1) |
| 1.0 | 1.0 | 1.0K |
| 2.0 | 1.0 | 2.0K |
| 2.0 | 4.0 | 4.0K |
�ɴ˿��Ƶã�m��nֵ��ȷ����
A��m=1��n=1 B��m= ��n=
��n= C��m=1��n=
C��m=1��n= D��m=
D��m= ��n=1
��n=1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������°�2 mol SO2��1 mol O2����һ��һ���ݻ����ܱ������У���Ӧ2SO2+O2 2SO3����ƽ��ʱ�����¶Ȳ��䣬�� a��b��c��ʾ��ʼʱSO2��O2��SO3�����ʵ������� a��b��cȡֵ��ͬ����������һ����ϵ���ܱ�֤�ﵽƽ��ʱ����Ӧ��������������������ƽ��ʱ��ȫ��ͬ����
2SO3����ƽ��ʱ�����¶Ȳ��䣬�� a��b��c��ʾ��ʼʱSO2��O2��SO3�����ʵ������� a��b��cȡֵ��ͬ����������һ����ϵ���ܱ�֤�ﵽƽ��ʱ����Ӧ��������������������ƽ��ʱ��ȫ��ͬ����
(1) a=0 mol b=0 mol c=____��
(2) a=0.5 mol ��b=____, c= ____��
(3) a��b��c ȡֵ��һ�������÷���ʽ��ʾ��
��һ��ֻ��a��c����һ��ֻ�� b��c��____________��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪0.1mol/L�Ĵ�����Һ���ڵ���ƽ�⣺CH3COOH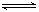 CH3COO- + H+������������ȷ����
CH3COO- + H+������������ȷ����
A��c(H+)+c(CH3COO-)+c(CH3COOH)=0.1mol/L
B����������0.1mol/L�����ᣬ����ƽ�������ƶ���c(H+)��С
C����������NaOH���壬����ƽ�������ƶ�����Һ��������ǿ
D����������CH3COONa���壬����ƽ�������ƶ�����Һ�����Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и������ʰ���������ʡ������˳�����е��ǣ� ��
A�� �ռҺ̬������� B����ʯ�ҡ���ʯ�ҡ�����
C�� �ɱ���ͭ���Ȼ��� D�� ����������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com