
分析 (1)依据元素化合价分析物质具有的氧化性还原性判断,元素化合价最高价具有氧化性,最低价具有还原性,据中间价态既具有氧化性又具有还原性;
(2)①在0.1mol•L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,依据氯水中的氯气具有强氧化性能氧化亚铁离子,溶液由浅绿色变为黄色;
②验证三价铁离子的方法是硫氰酸钾溶液遇铁离子变血红色判断;
③氧化还原反应中还原剂的还原性大于还原产物分析判断;
(3)①若Fe2+在反应中表现出氧化性,化合价降低到0价,为Fe;若Fe2+在反应中表现出还原性需要元素化合价升高,变化为三价铁离子;
②防止亚铁盐溶液被氧化,需要加入铁粉.
解答 解:(1)元素化合价处于最高价只具有氧化性,处于最低价只具有还原性,处于中间价态既可以升高也可以降低,既具有氧化性又具有还原性;
故答案为:因为Fe2+中铁元素化合价处于中间价态,可以升高也可以降低;
(2)①在0.1mol•L-1FeCl2溶液滴入新制氯水,氯气具有强氧化性能源和亚铁离子为铁离子,反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;
溶液颜色从浅绿色变为棕黄(黄)色;
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;棕黄(黄);
②通过检验Fe2+被氧化的产物Fe3+的存在以获取证据.需要的试剂为硫氰酸钾溶液,发生反应,Fe3++3SCN-=Fe(SCN)3,溶液变血红色,
故答案为:KSCN溶液;溶液呈血红;
③金属单质都具有还原性,分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小,发生反应Zn+Fe2+=Fe+Zn2+;氧化还原反应中还原剂的还原性大于还原产物,锌的还原性大于铁,铁大于铜,
故答案为:Zn Fe Cu (或Zn>Fe>Cu);
(3)①若Fe2+在反应中表现出氧化性,化合价降低做氧化剂,只能降到0价为金属铁,若Fe2+在反应中表现出还原性,铁元素化合价升高为三价,应转化成三价铁离子;
故答案为:Fe,Fe3+;
②实验室的FeCl2溶液常因氧化而变质,为反之亚铁离子的氧化,需要加入还原铁粉,发生反应2Fe3++Fe=3Fe2+,所以避免亚铁离子的氧化,需加入过量铁粉,过滤,
故答案为:加入过量铁粉,过滤;2Fe3++Fe=3Fe2+.
点评 本题考查了元素化合价变化与氧化性还原性的关系判断,铁及其化合物性质的应用,离子检验的方法应用,氧化还原反应概念的分析判断,题目难度中等.


科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列家庭化学小实验不能达到预期目的的是
A.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用米汤检验食用加碘盐(含KIO3)中含有碘元素
D.用明矾:KAl(SO4)2·12H2O,可净化水。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D |  | 烧杯中有白色胶状沉淀生成 | 非金属性:N>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
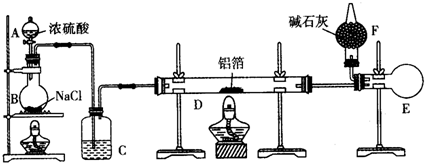
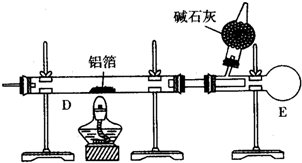
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为3mol/L | B. | 上述电解过程中共转移4 mol电子 | ||
| C. | 电解得到的Cu的物质的量为0.5mol | D. | 电解后溶液上c(H+)为4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
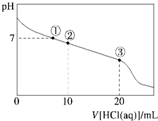 常温下,向20.00mL 0.100mol•L-1 CH3COONa溶液中逐滴加入0.100 0mol•L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( )
常温下,向20.00mL 0.100mol•L-1 CH3COONa溶液中逐滴加入0.100 0mol•L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( )| A. | 点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) | |
| B. | 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中可能出现:c(H+)+c(Na+)═c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com