
分析 (1)熔融状态下NaHSO4的电离出钠离子和硫酸氢根离子;
(2)H2CO3的分步可逆电离;
(3)氢氧化铁为弱碱,可逆电离但一步写;
(4)NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子.
解答 解(1)熔融状态下NaHSO4的电离出钠离子和硫酸氢根离子,电离方程式为NaHSO4=Na++HSO4-,故答案为:NaHSO4=Na++HSO4-;
(2)H2CO3的分步可逆电离,电离方程式为H2CO3?HCO3-+H+,HCO3-?H++CO32-,故答案为:H2CO3?HCO3-+H+,HCO3-?H++CO32-;
(3)氢氧化铁为弱碱,可逆电离出铁离子和氢氧根离子,但可一步写,电离方程式为Fe(OH)3?Fe3++3OH-,故答案为:Fe(OH)3?Fe3++3OH-;
(4)NaHSO4是强酸强碱酸式盐,属强电解质,完全电离,电离出Na+、H+、SO42-离子,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-.
点评 本题考查电离方程式的书写,明确电解质的强弱及常见的酸根离子,并利用电荷守恒是解答关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 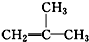 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为: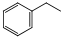 (g)$?_{高温(T)}^{Fe_{2}O_{3}}$
(g)$?_{高温(T)}^{Fe_{2}O_{3}}$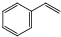 (g)+H2(g)△H=+120kJ•mol-1
(g)+H2(g)△H=+120kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题

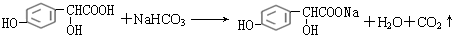 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
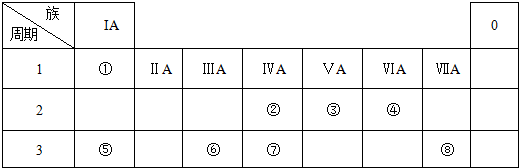
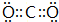 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO=2Fe+3CO2△H=-28.5kJ•mol-1( ) | |
| B. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ | |
| C. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=+28.5kJ•mol-1 | |
| D. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com