
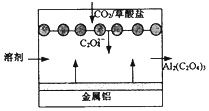
| A. | 该装置是将电能转变为化学能 | |
| B. | 正极的电极反应为:C2O42--2e-=2CO2 | |
| C. | 每得到1 mol草酸铝,电路中转移3 mol电子 | |
| D. | 利用该技术可捕捉大气中的CO2 |
分析 “碳呼吸电池”中,根据工作原理图,金属铝是负极失电子生成草酸铝,以“呼出”的CO2作为正极反应物得电子生成草酸根,据此解答.
解答 解:A、“碳呼吸电池”为原电池原理,将化学能转变为电能,故A错误;
B、根据工作原理图,“呼出”CO2作为正极反应物得电子生成草酸根,电极反应为:2CO2+2e-=C2O42-,故B错误;
C、根据工作原理图,金属铝是负极失电子生成草酸铝,所以每得到1 mol草酸铝,电路中转移3×2=6mol电子,故C错误;
D、“碳呼吸电池”能消耗二氧化碳气体,所以利用该技术可捕捉大气中的CO2,故D正确;
故选D.
点评 本题考查电化学的相关知识、电极反应式的书写等知识点,注意电极反应式的书写,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
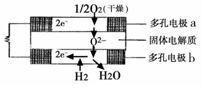 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | 该电池的总反应方程式为:2H2+O2=2H2O | |
| B. | 电子由a极流向b极 | |
| C. | a极对应的电极反应式为2H2O+O2-4e=4OH- | |
| D. | 有O2参加反应的a极为电池的阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国首艘航母“辽宁舰”上用于载机降落的拦阻索是特种钢缆,属于金属材料 | |
| B. | 研制高性能的耐磨轮胎,可减少PM2.5等颗粒物的产生 | |
| C. | 采用纳米TiO2光触媒技术,将装修材料中释放的HCHO转化为无害物质 | |
| D. | 高纯度的硅单质广泛用于光导纤维,光导纤维遇强碱会造成“短路” |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
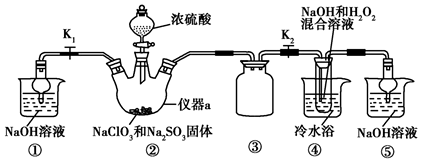
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(W)>r(Z)>r(Y) | |
| B. | Z的最高价氧化物对应水化物的碱性比W的强 | |
| C. | 化合物X2Y2和Z2Y2所含化学键类型完全相同 | |
| D. | 工业上常用电解熔融W的氧化物制备W的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
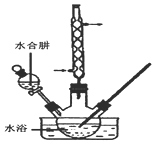 碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等.实验室用NaOH、单质碘和水合肼为原料制得,部分装置如图所示.
碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等.实验室用NaOH、单质碘和水合肼为原料制得,部分装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化镁与稀硫酸:MgO+2H+═Mg2++H2O | |
| D. | 常温下,将铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、SO42-、NO3- | B. | Al3+、K+、Cl-、HCO3- | ||
| C. | Na+、Fe3+、NO3-、CO32- | D. | Mg2+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中可以显酸性的物质是酸 | |
| B. | 电离时产生的阳离子中有H+的化合物是酸 | |
| C. | 电离时产生的阴离子全部是OH-的化合物是碱 | |
| D. | 盐只能电离出金属阳离子和酸根离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com