
| A、乙醇、糖类和蛋白质都是人体必需的营养物质 |
B、NH4I的电子式: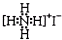 |
| C、石油是混合物,其分馏产品汽油也是混合物 |
| D、陶瓷、水晶、水泥、玻璃都属于硅酸盐 |
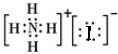 ,故B错误;
,故B错误;

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、原子序数:W>Z>X>Y |
| B、离子半径:r(W2+)>r(X-)>r(Y2-)>r(Z+) |
| C、Y的气态氢化物比X的气态氢化物稳定 |
| D、氢氧化物碱性强弱:W(OH)2>ZOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
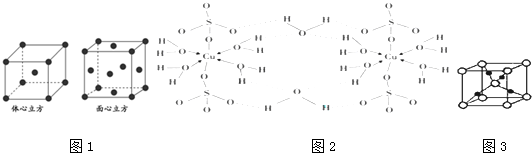
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2FeO4水溶液能产生丁达尔效应 |
| B、K2FeO4水溶液具有吸附性 |
| C、K2FeO4溶液能除去氧化性杂质 |
| D、Na2FeO4制K2FeO4的反应为复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、17种 | B、18种 |
| C、19种 | D、20种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
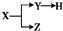 表示一些物质间的从属关系,不正确的是( )
表示一些物质间的从属关系,不正确的是( )| X | Y | Z | H | |
| A | 分散系 | 胶体 | 溶液 | 大雾 |
| B | 电解质 | 酸 | 碱 | 盐 |
| C | 元素周期表的纵列 | 主族 | 副族 | 卤族 |
| D | 化合物 | 共价化合物 | 离子化合物 | 酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl) |
| B、等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com