
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) =" +28.7" kJ·mol-1 =" +28.7" kJ·mol-1 |
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) =" -28.7" kJ·mol-1 =" -28.7" kJ·mol-1 |
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) =" +57.4" kJ·mol-1 =" +57.4" kJ·mol-1 |
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) =" -57.4" kJ·mol-1 =" -57.4" kJ·mol-1 |
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源:不详 题型:填空题

| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaSO3 | BaSO3 |
| 0.160 | 3.89 | 6.76×10-3 | 5.48×10-9 |
 =____________(写出表达式即可)。
=____________(写出表达式即可)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。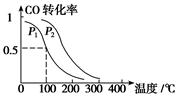

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断: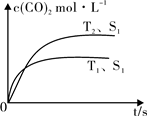
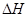 =-867kJ·mol-1
=-867kJ·mol-1 N2O4(g)
N2O4(g) 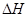 =-56.9kJ·mol-1
=-56.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++CN-电离的ΔH为 kJ·mol-1
H++CN-电离的ΔH为 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1| A.+41.2 kJ?mol-1 | B.-41.2 kJ?mol-1 | C.+82.4kJ?mol-1 | D.-524.8 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2N (g)
2N (g) 2H (g)
2H (g)
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 O2(g)=CO2(g)的 △H= kJ ? mol-1。
O2(g)=CO2(g)的 △H= kJ ? mol-1。 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
 CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com