

分析 (1)①光化学烟雾(或硝酸型酸雨)都是氮的氧化物引起的;
②已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),据此计算;
③氮的化合价降低,所以氧化剂是一氧化氮;
(2)该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,据此分析解答.
解答 解:(1)①光化学烟雾(或硝酸型酸雨)都是氮的氧化物引起的,故答案为:光化学烟雾(或硝酸型酸雨);
②已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H=-890.3kJ•mol-1-2×(+180kJ•mol-1)=-1250.3 kJ•mol-1;
故答案为:-1250.3 kJ•mol-1;
③氮的化合价降低,所以氧化剂是一氧化氮,故答案为:NO;
(2)该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,
①该原电池中,硝酸根离子得电子发生还原反应,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,则右边装置中电极b是正极,故答案为:b;
②左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,故答案为:C6H10O5-24e-+7H2O═6CO2↑+24H+;
③放电时,电解质溶液中阳离子Na+移向正极右室即向b电极,阴离子Cl-移向负极室左室即a电极,故答案为:b电极;a电极;
④整个电路转移120mol电子时,负极生成30mol的二氧化碳气体,正极生成12mol的氮气,除理氯化钠120mol,得到关系式为:
42mol气体~~120molNaCl,
42×22.4 120×58.5
7.84 2.34%×m
则42×22.4×2.34%×m=7.84×120×58.5
解之得x=2500g,故答案为:2500.
点评 本题考查化学反应热和化学电源新型电池,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
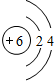 .
. ;写出C2B2的电子式
;写出C2B2的电子式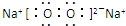 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | 容器中各组分的体积分数不随时间变化容器内 | |
| C. | AB的消耗速率等于A2的消耗速率 | |
| D. | 3种气体AB、A2、B2共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终可以生成2 mol NH 3 | |
| B. | 单位时间内,若消耗了0.5mol N2的同时,生成1 mol NH3,则反应达到平衡 | |
| C. | 反应达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1:3:2 | |
| D. | 反应达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验操作 | 预期现象及结论 |
| 1 | 取少量所得溶液于试管中, 再滴入几滴稀盐酸 | 若无气泡产生,证明原溶液中不含有Na2CO3 |
| 2 | 另取少量所得溶液于试管中, 再滴入几滴Na2CO3溶液 | 若无沉淀产生,结合步骤1,猜想一成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 肼和氧气在相同催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
肼和氧气在相同催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:| A. | v(N2)=v(NO) | |
| B. | 反应①的△H保持恒定 | |
| C. | 体系的密度不再发生变化 | |
| D. | 混合气体的平均相对分子质量不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、C、O、K | B. | H、N、O | C. | H、O、S | D. | H、O、S、Na |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学电源名称 | 正极反应式 | 负极反应式 | 电解质溶液pH的变化 |
| 碱性氢氧燃料电池 | O2+2H2O+4e-=4OH- | 此空不用填写 | 变小 |
| 碱性甲烷燃料电池 | 此空不用填写 | CH4+8e-+10OH-=CO32-+7H2O | 变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com