
在一个1 L的密闭容器中,加入2mol A和1mol B,发生下列反应:2A(g)+B(g)3C(g)+D(s),达到平衡时,C的浓度为1.2mol·L-1。
(1)维持容器的温度不变,若缩小容器的体积,则平衡________
移动(填“向正反应方向”或“向逆反应方向”或“不”)。
(2)维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2mol·L-1的是__________。
A.4mol A+2mol B
B.3mol C+1mol D
C.2mol A+1mol B+1mol D
(3)若维持容器内的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol·L-1,则C的起始物质的量应满足的条件是__________。
答案 (1)不
(2)BC
(3)1.2mol<n(C)≤3mol
解析 (1)因为所给反应是气体体积不变的反应,所以维持容器的温度不变,缩小容器体积,即增大压强,平衡不发生移动。
(2)保持体积和温度不变,按A、B、C配比作为起始物质与加入2mol A和1mol B平衡等效。但本题要求C的浓度为1.2mol·L-1,即要求数值相等,故A项不符合。
(3)在1 L的密闭容器中,加入2mol A和1mol B,发生反应2A(g)+B(g)3C(g)+D(s)达到平衡时,C的浓度为1.2mol·L-1。因为若2mol A和1mol B完全反应则生成3mol C,所以保持体积和温度不变,反应从逆反应开始,要使达到平衡时C的浓度仍是1.2mol·L-1,C的起始物质的量应满足的条件是:1.2mol<n(C)≤3mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某溶液中存在五种离子: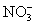 、
、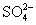 、Fe3+、H+和一种未知离子(OH-忽略不计),它们物质的量浓度之比为2∶3∶1∶3∶1,则未知离子可能为 ( )
、Fe3+、H+和一种未知离子(OH-忽略不计),它们物质的量浓度之比为2∶3∶1∶3∶1,则未知离子可能为 ( )
A.Fe2+ B.Ba2+ C.Cl- D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g)在2 L密闭容器中进行1 分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
A.NO:0.001mol·L-1
B.H2O:0.002mol·L-1
C.NH3:0.002mol·L-1
D.O2:0.0025mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中反应mA(g)nB(g)达到平衡后,保持温度不变,改变容器体积(V),B的浓度变化如图所示,以下判断正确的是( )
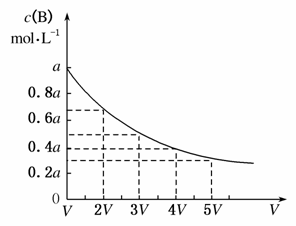
A.物质B的质量分数增大
B.平衡向逆反应方向移动
C.物质A的转化率减小
D.化学计量数:m>n
查看答案和解析>>
科目:高中化学 来源: 题型:
对于化学反应方向的确定不仅与焓变(ΔH)有关,也与温度(T)、熵变(ΔS)有关,实验证明,化学反应的方向应由ΔH-TΔS确定,若ΔH-TΔS<0则自发进行,否则不能自发进行。下列说法中,正确的是( )
A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向
B.温度、压强一定时,放热的熵增加反应一定能自发进行
C.反应焓变是决定反应能否自发进行的唯一因素
D.固体的溶解过程与焓变有关
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A+3B2C+D在某段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5 mol·L-1·min-1
B.1 mol·L-1·min-1
C.2 mol·L-1·min-1
D.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是( )
A.在此反应中硝酸只体现强氧化性
B.向反应后的溶液中再加入金属铁,不再发生化学反应
C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4
D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH-—→2CO +12H2O+14e-、7H2O+7/2O2+14e-—→14OH-,有关此电池的推断正确的是( )
+12H2O+14e-、7H2O+7/2O2+14e-—→14OH-,有关此电池的推断正确的是( )
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中,CO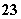 向正极移动
向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com