

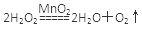 (2分)
(2分)

科目:高中化学 来源:不详 题型:单选题
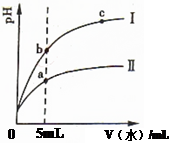
| A.Ⅰ为醋酸稀释时pH变化曲线 |
| B.溶液的导电性:b>a>c |
| C.取“0”处等体积的两者溶液分别加足量铁粉,放出H2的量:醋酸>盐酸 |
| D.取5mL处等体积两者溶液分别与相同的Zn粒反应,开始时的反应速率:Ⅰ>Ⅱ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法,
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法,| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(气)若经 2 秒后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示反应的平均速率为 0.3 mol·L-1·s-1②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为30% ④ 2 s 时物质 B 的浓度为 1.4 mol·L-1 ,其中正确的是
2C(气)若经 2 秒后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示反应的平均速率为 0.3 mol·L-1·s-1②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为30% ④ 2 s 时物质 B 的浓度为 1.4 mol·L-1 ,其中正确的是| A.①④ | B.①③ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 图4 图5 图6 图7
图4 图5 图6 图7查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是
2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是 | A.SO2为0.4mol/L,O2为0.2mol/L | B.SO3(g)为0.4mol/L |
| C.SO2、SO3(g)均为0.15mol/L | D.SO2为0.25mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
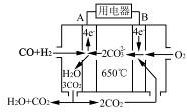
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g) △H<0,平衡时测得A的浓度为0.5mol/L保持温度不变,将容器的容积缩小到原来的一半,再达平衡时测得A的浓度为1.2mol/L下列有关判断正确的是
pC(g) △H<0,平衡时测得A的浓度为0.5mol/L保持温度不变,将容器的容积缩小到原来的一半,再达平衡时测得A的浓度为1.2mol/L下列有关判断正确的是| A.C的体积分数下降 |
| B.a + b > p |
| C.正反应速率和逆反应速率均减小,平衡向逆反应方向移动 |
| D.正反应速率和逆反应速率均加大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用完的干电池可以随意地丢弃 |
| B.增加炼铁高炉的高度不可以降低尾气中CO的含量 |
| C.使用催化剂一定能加快化学反应速率 |
| D.把煤粉碎了再燃烧可以降低环境污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com