


分析 将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品,为防止二氧化碳的干扰,应将空气中的二氧化碳用碱液除掉,通过碱石灰干燥吸收水蒸气,进入装置C加热反应,反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),生成的二氧化硫气体进入装置D被过滤氢氧化钠溶液吸收得到亚硫酸钠溶液,
(1)为防止二氧化碳的干扰,应将空气中的二氧化碳用碱液除掉,通过碱石灰干燥吸收水蒸气,生成的二氧化硫能和氢氧化钠反应生成盐;
(2)亚硫酸根离子能被过氧化氢氧化生成硫酸根离子;洗涤固体在过滤器中进行,加水至浸没固体使水自然流下,重复几次洗涤干净,m2g固体为硫酸钡的质量,结合硫元素守恒计算得到硫元素的质量分数;
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是加入硫酸溶解后加入高锰酸钾溶液观察高锰酸钾溶液是否褪色设计检验方案;
(4)泡铜成分为Cu、Cu2O,Cu+在强酸性环境中会发生反应生成Cu和Cu2+.据此设计实验验证是否含有氧化亚铜;
解答 解:(1)为防止二氧化碳的干扰,应将空气中的二氧化碳用碱液除掉,锥形瓶A内所盛试剂是氢氧化钠溶液,通过碱石灰干燥吸收水蒸气,生成的二氧化硫能和过量氢氧化钠反应生成亚硫酸钠盐和水,反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:氢氧化钠,干燥气体,SO2+2OH-=SO32-+H2O;
(2)亚硫酸根离子具有还原性能被过氧化氢氧化生成硫酸根离子,反应的离子方程式为:H2O2+SO32-=SO42-+H2O,洗涤固体在过滤器中进行,加水至浸没固体使水自然流下,重复几次洗涤干净,具体操作为:固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待滤液自然流下后,重复上述操作2-3次,m2g固体为硫酸钡的质量,结合硫元素守恒计算得到硫元素的质量分数=$\frac{\frac{{m}_{2}g}{233g/mol}×32g/mol}{{m}_{1}}$×100%=$\frac{32{m}_{2}}{233{m}_{1}}$×100%,
故答案为:H2O2+SO32-=SO42-+H2O,固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待滤液自然流下后,重复上述操作2-3次,$\frac{32{m}_{2}}{233{m}_{1}}$×100%;
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是加入硫酸溶解后加入高锰酸钾溶液观察高锰酸钾溶液是否褪色设计检验方案;
(4)泡铜成分为Cu、Cu2O,Cu+在强酸性环境中会发生反应生成Cu和Cu2+.据此设计实验验证是否含有氧化亚铜,取少量泡铜于试管中加入适量稀硫酸,若溶液呈蓝色说明泡铜中含有Cu2O,否则不含有,
故答案为:取少量泡铜于试管中加入适量稀硫酸,若溶液呈蓝色说明泡铜中含有Cu2O,否则不含有;
点评 本题考查混合物的分离和提纯,主要是物质性质、实验基本操作和实验探究设计等知识点,关键是提取题中的信息,根据所学知识完成,题目难度中等.


科目:高中化学 来源: 题型:解答题
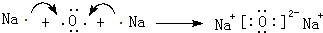 、
、 .
.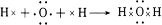 、
、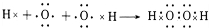 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 25℃时,若将pH=3的盐酸与pH=11的氨水混合后溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 结合H+的能力:CO32->HCO3->CN->HCOO- | |
| D. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
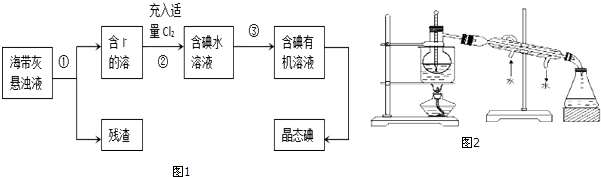
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
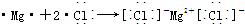 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
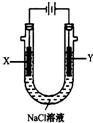
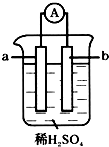 已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )| A. | 碳棒上有气体放出,溶液酸性变弱 | B. | a是正极,b是负极 | ||
| C. | 导线中有电子从a极到b极 | D. | a极上发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com