
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
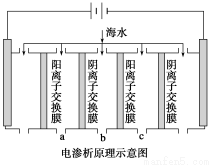
①阴极的电极反应式为__________________。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式______________________________________。
③淡水的出口为a、b、c中的________出口。
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
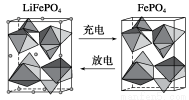
该电池电解质为传导Li+的固体材料。放电时该电极是电池的________极(填“正”或“负”),电极反应式为______________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
C5H12有3种不同结构:甲CH3(CH2)3CH3,乙CH3CH(CH3)CH2CH3,丙C(CH3)4。下列相关叙述正确的是( )
A.甲、乙、丙属同系物,均可与氯气、溴蒸气发生取代反应
B.C5H12表示一种纯净物
C.甲、乙、丙中,丙的沸点最低
D.丙有3种不同沸点的二氯取代物
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:填空题
单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应:
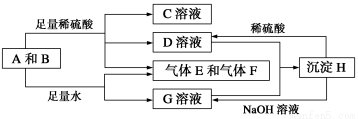
请回答下列问题:
(1)组成A单质的元素在周期表中处于第__________周期__________族。
(2)化合物B的电子式为________________________。
(3)D与G两溶液混合后发生反应的离子方程式为______________________________
(4)常温下,D溶液的pH________7(填“>”、“<”或“=”),其原因是____________________________(用离子方程式表示)。
(5)10.8 g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为________ g。
(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______________________。以该电池为电源,用惰性电极电解100 g 8%的C溶液,电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在准状况下的体积共为________ L,电路上通过电子的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:选择题
能说明元素X的原子得电子能力强于元素Y的原子的事实是( )
A.元素周期表中元素X位于元素Y的上一个周期
B.元素X的含氧酸的酸性强于元素Y的含氧酸
C.分别加热H2X、HY至500 ℃,只有HY发生分解
D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一。下列说法正确的是( )
A.原子半径的大小顺序:rX>rY>rW>rQ
B.X、Y的最高价氧化物的水化物之间不能反应
C.Z、W最外层电子数都为6,最高化合价都为+6价
D.元素Q和Z能形成QZ2型的共价化合物
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:选择题
太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如图)。已知发出白光的LED是将GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。下列说法中不正确的是( )
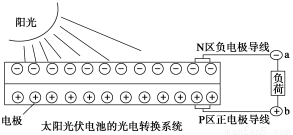
A.光伏发电是将太阳能转变为电能
B.上图中N区半导体为负极,P区半导体为正极,电流从a流向b
C.YAG中钇显+3价
D.Ga与N在元素周期表中不处于同一主族
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:填空题
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是__________________。
(2)D的化学式为__________________,D溶液显碱性的原因是_________________(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是______________________________________;
E和氨水反应的离子方程式是____________________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是______________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:选择题
已知硫铁矿在沸腾炉中煅烧(4FeS2+11O2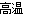 8SO2+2Fe2O3),通入沸腾炉中的气体原料是过量的空气,其中N2的体积分数为0.80,O2的体积分数为0.20,则沸腾炉排出的气体中SO2的体积分数可能是( )
8SO2+2Fe2O3),通入沸腾炉中的气体原料是过量的空气,其中N2的体积分数为0.80,O2的体积分数为0.20,则沸腾炉排出的气体中SO2的体积分数可能是( )
A.0.18 B.0.12 C.0.16 D.0.20
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:选择题
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)  CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
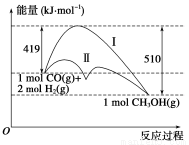
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com