
(10分)某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验,回答下列问题:
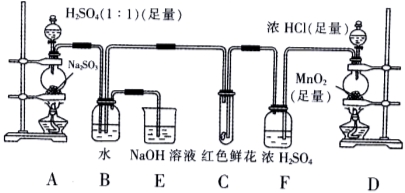
(1)写出A装置中玻璃仪器的名称:酒精灯、______、 。
(2)实验开始后,写出B中反应的离子方程式_______________________。
(3)C中的现象是______________,E装置的作用是_____________________。
(4)某学生按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应。然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g。请你计算原样品中Na2SO3的纯度为________(精确到0.1%)。
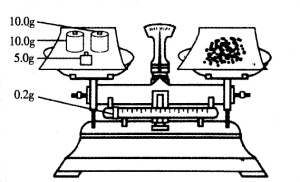
(5)在过滤沉淀时若滤液出现浑浊,则必须要重复操作,若该学生没有重复过滤,则测定的结果将______(填“偏高”、“偏低”或“无影响”)。
(6)要使测定结果准确,第一:装置气密性必须良好;第二:应先点燃___处酒精灯(填装置字母)。
(1)圆底烧瓶、分液漏斗
(2)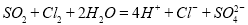
(3)红色鲜花褪色 吸收未反应的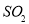 和
和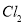 (尾气处理)
(尾气处理)
(4)50.8% (5)偏低 (6)D
【解析】
试题分析:本题实验目的测定部分变质的Na2SO3样品的纯度,本实验题分两部分,第一部分是一个定性实验是分别制备SO2和Cl2,并验证Cl2使鲜花褪色及SO2与Cl2反应,因为鲜花中含水分,Cl2与水反应生成HClO使鲜花褪色;SO2和Cl2均为污染性气体,故E中NaOH溶液作用是尾气处理吸收多余的SO2和Cl2。第二部分是定量实验是利用BaCl2与上述实验中生成的SO42—反应生成BaSO4的量来测定样品的纯度,本实验要求必须Cl2需过量且SO2不能损失,故要先点燃D处酒精灯,最后称得沉淀质量为23.3g即0.1mol,则根据Na2SO3 ~ SO2 ~ SO42—~ BaSO4可知原固体中Na2SO3为0.1mol即12.6g,由图中天平可知天平称量本应为左物右码,但图中天平为左码右物故样品质量为25—0.2=24.8g,则其纯度==12.6g/24.8g ==50.8%;(5)中问题滤液出现浑浊说明有固体物质通过滤纸造成滤渣损失,即导致BaSO4质量损失,根据Na2SO3 ~ SO2 ~ SO42—~ BaSO4可知会导致最后结果偏低。
考点:基础实验考察及定性、定量实验分析考察。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
下列操作不能达到目的的是
A.将25gCuSO4·5H2O溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液
B.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体
C.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
D.用银氨溶液鉴别葡萄糖和蔗糖
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
现有FeSO4、Fe2(SO4)3、H2SO4的混合溶液,其中c(H+)=0.10mol/L.取该溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀27.96g;再另取该混合溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.00g.则原混合溶液中c(Fe2+)与c(Fe3+)之比为( )
A.4:1 B.3:1 C.2:1 D.1:1
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
某溶液中含有下列六种离子:①HCO3- ②SO32- ③Na+ ④CO32- ⑤NH4+⑥NO3—,向其中加入一定量Na2O2后,溶液中离子浓度基本保持不变的是
A.只有⑥ B.④⑥ C.③④⑥ D.①②⑤
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
生活处处有化学,下列说法正确的是( )
A.制饭勺、饭盒、高压锅等的不锈钢是合金
B.做衣服的棉和麻均与淀粉互为同分异构体
C.煎炸食物的花生油和牛油都是可皂化的饱和酯类
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源:2015届河北省石家庄市五校联考高三上学期第一次月考化学试卷(解析版) 题型:选择题
甲、乙两烧杯中各盛有 的盐酸和
的盐酸和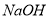 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
查看答案和解析>>
科目:高中化学 来源:2015届河北省石家庄市五校联考高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.同主族元素的单质从上到下,熔点升高
B.元素的最高正化合价在数值上等于它所在的族序数
C.同周期主族元素的原子半径越小,越难失去电子
D.元素的非金属性越强,它的气态氢化物水溶液的酸性越强
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三10月月考理综化学试卷(解析版) 题型:填空题
(14分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法:2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol—1;
②2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;
③2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1.
方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。
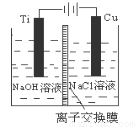
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:
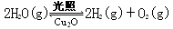 ⊿H >0
⊿H >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:选择题
室温下,在0.2mol/LAl2(SO4)3,溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是( )
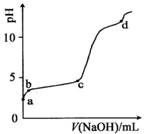
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH- Al(OH)3
Al(OH)3
B.d点时,Al(OH)3沉淀开始溶解
C.a-b段,溶液pH增大,A13+浓度不变
D.b-c段,加入的OH-主要用于生成AI(OH)3沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com