
【题目】如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( ) 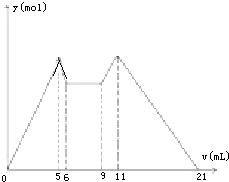
A.A是盐酸,B是NaOH,且C(NaOH)=2C(HCl)
B.原混合液中,C(Al3+):C(Mg2+):C(Cl﹣)=1:1:5
C.A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1
D.从6到9,相应离子反应式H++OH﹣═H2O
【答案】A
【解析】解:A.向混合溶液中加入A时立即生成沉淀,氢氧化钠和氯化镁、氯化铝生成沉淀,稀盐酸和氯化铝、氯化镁不反应,所以A是NaOH;改用B时又生成沉淀且当B过量时沉淀溶解,则B是稀盐酸,故A错误;B.从加入5 mL A生成沉淀最多,再继续加1 mL 甲沉淀量减少到最小值,相应反应的离子方程式为:
Al(OH)3+OH﹣=AlO2﹣+2H2O,由此可知,n(Al3+)=n〔Al(OH)3〕=(1×6×10﹣3) mol;
由前5 mL NaOH形成最大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10﹣3×6)mol,所以n(Mg2+)=(1×6×10﹣3) mol;溶液中阴阳离子所带电荷相等得,n(Cl﹣)=(5×10﹣3×6)mol,即溶液中c(Mg2+):c(Al3+):c(Cl﹣)=1:1:5,故B正确.
C.又由图可知,5→6(1 mL)、9→11(2mL)分别是溶解Al(OH)3和使AlO2﹣恰好完全生成Al(OH)3沉淀消耗的NaOH和HCl.根据铝元素守恒:
NaOH﹣Al(OH)3﹣AlO2﹣﹣H+
1 11 1
由此可以推出:c(NaOH):c(HCl)=2:1,故C正确.
D、由6mL和9mL对应液体中沉淀量相等,可以推知此时仅仅发生酸碱中和反应,即H++OH﹣=H2O,故D正确;
故选A.


科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2 , ②KClO3+6HCl=3Cl2+KCl+3H2O,③2KBrO3+Cl2=Br2+2KClO3 , 下列说法正确的是( )
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为6:1
D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
(1)仪器A冷却水的进水口为(填“a”或“b”)。
(2)仪器B中盛放的药品是。
(3)实验时,装置丁中发生反应的离子方程式为。
(4)装置丙的作用为 , 若缺少装置乙,则硫酰氯会水解,该反应的化学
方程式为。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+ SO2Cl2 , 此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g) ![]() CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下: 
则x=。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) ![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压
强的关系如下图所示。
①a、b两点的反应速率:v(a)v(b)(填“>”“<”或“=”)。
②T1T2(填“>”“<”或“=”),原因是。
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④图中a点的平衡常数KP=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:I:CO(g)+2H2(g) ![]() CH3OH(g) H1II:CO2(g)+H2(g)
CH3OH(g) H1II:CO2(g)+H2(g) ![]() CO(g) + H2O(g) H2III:CO2(g)+3H2(g)
CO(g) + H2O(g) H2III:CO2(g)+3H2(g) ![]() CH3OH(g) + H2O(g) H3
CH3OH(g) + H2O(g) H3
上述反应对应的平衡常数分别为K1、K2、K3 , 它们随温度变化曲线如下图所示。
则H1H3(填“>”、“<”、“=”), 理由是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的类型说法正确的是( )
A. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
B. 非金属元素组成的化合物中只含共价键
C. H与O、H与N均可形成既含极性共价键又含非极性共价键的化合物
D. NaHCO3和HCOONa都只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)2C(g),若经2s后测得C的浓度为0.6molL﹣1 , 现有下列几种说法:
①用物质A表示的反应的平均速率为0.3molL﹣1s﹣1
②用物质B表示的反应的平均速率为0.6molL﹣1s﹣1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7molL﹣1
其中正确的是( )
A.①③
B.①④
C.②③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,其中氢叠氮酸(HN3)是一种弱酸,分子结构示意图可表示为: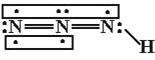
联氨被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2=2H2O+HN3
它的酸性类似于醋酸,微弱电离出H+和N。试回答下列问题:
(1)下列有关说法正确的是_____________(选填序号)。
A.HN3中含有5个σ键
B.HN3中三个氮原子采用的都是sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.肼(N2H4)沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+及Cu2+及Co3+等形成配合物,如:Co[(N3)(NH3)5]SO4 , 在该配合物中钴显价,根据价层互斥理论可知SO空间形状为 , 写出钴原子在基态时的核外电子排布式。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是_____(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如上图,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(4)与N互为等电子体的分子有(举2例)
(5)人造立方氮化硼的硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。立方氮化硼晶胞如下图所示,试分析: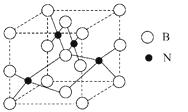
①该晶体的类别为晶体。
②晶体中每个N同时吸引个B。
③设该晶体的摩尔质量为M g·mol-1 , 晶体的密度
为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则晶体
中两个距离最近的B之间的距离为cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A.2KI+Br2═2KBr+I2
B.CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
C.SO3+H2O ![]() H2SO4
H2SO4
D.MgCl2+2NaOH ![]() Mg(OH)2↓+NaCl
Mg(OH)2↓+NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com