
在固定体积的密闭容器中进行如下反应:2SO2(g) + O2(g)  2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
| A.SO2、O2分别为0.4mol?L-1、0.2mol?L-1 | B.SO2为0.25mol?L-1 |
| C.SO2、SO3均为0.15mol?L-1 | D.SO3为0.4mol?L-1 |
B
解析试题分析:用假设法、三行数据法先求逆反应进行到底时各组分浓度的极限值,再求正反应进行到底时各组分浓度的极限值,然后根据可逆反应不能进行到底或转化率不可能是100%判断各组分浓度的取值范围,从而确定答案。先假设逆反应进行到底,则:
2SO2(g) + O2(g)  2 SO3(g)
2 SO3(g)
各组分的起始浓度/ mol?L-1 0.2 0.1 0.2
各组分的变化浓度/ mol?L-1 0.2 0.1 0.2
各组分的平衡浓度/ mol?L-1 0.4 0.2 0
再假设正反应进行到底,则:
2SO2(g) + O2(g)  2 SO3(g)
2 SO3(g)
各组分的起始浓度/ mol?L-1 0.2 0.1 0.2
各组分的变化浓度/ mol?L-1 0.2 0.1 0.2
各组分的平衡浓度/ mol?L-1 0 0 0.4
由于正、逆反应都不可能进行到底,则达到平衡时二氧化硫的浓度:0<c(SO2)<0.4 mol?L-1,氧气的浓度:0<c(O2)<0.2 mol?L-1,三氧化硫的浓度:0<c(SO3)<0.4 mol?L-1,故AD均错,B正确;若二氧化硫的浓度减小,说明反应正向进行,则三氧化硫的浓度增大,不可能二者同时减小,故C错。
考点:考查可逆反应的特点,涉及物质的量在化学方程式中的应用、可逆反应、各组分三行数据(起始浓度、变化浓度、平衡浓度)的关系、各组分浓度的极限值和取值范围、反应物浓度和生成物浓度变化关系等。


科目:高中化学 来源: 题型:单选题
下列事实不能用勒夏特列原理解释的是
| A.配制氯化铁溶液时,加入少量稀盐酸 |
| B.配制氯化亚铁溶液时,加入少量铁屑 |
| C.在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 |
| D.在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 2B(g) xC(g)ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是 ( )
xC(g)ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是 ( )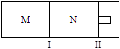
| A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) |
| B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N) |
| C.若x<3,C的平衡浓度关系为:c(M)>c(N) |
| D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于下列各图的叙述,正确的是
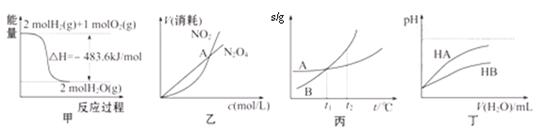
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热(△H)为—241.8 kJ·mol-1
B.乙表示恒温恒容条件下,2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生反应,在10 min时达到平衡:PCl3(g)+Cl2(g) PCl5(g)。有关数据如下:
PCl5(g)。有关数据如下:
| | PCl3(g) | Cl2(g) | PCl5(g) |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一密闭容器中发生反应:2X(g)+Y(g) aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
| A.图甲,P1>P2,a < 3 |
| B.图甲,T1<T2,Q>0 |
| C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体 |
| D.图乙,如果a=3, t2时表示向体系中加入了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应:C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,化学反应方向的判据为:△G=△H-T△S。已知反应A(s)= D(g)+E(g),△H-T△S=(-4499+11T)J/mol,(温度单位为K)。要防止A分解反应发生,温度必须( )
| A.高于或等于409K | B.低于136K |
| C.高于136K而且低于409K | D.任意温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g) 2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是 ( )
2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是 ( )
A.若反应开始时容器体积为2L,则Vc=0.4mol?L-1?min-1
B.若在恒压绝热条件下反应,平衡后nc<<1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com