
A��B��C��D��E��F����Ԫ�ص�ԭ��������������A��������ۺ�����۵ľ���ֵ��ȣ�B�Ļ�̬ԭ����3����ͬ���ܼ��Ҹ��ܼ��е�������ȣ�D�Ļ�̬ԭ����B�Ļ�̬ԭ�ӵ�δ�ɶԵ�����Ŀ��ͬ��E�Ļ�̬ԭ�ӵ�s�ܼ��ĵ���������p�ܼ��ĵ�������ȣ�F�Ļ�̬ԭ�ӵ�3d�����������4s��������4������ش��������⣺
��1��F�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ ��
��2��B��C��D��E��ԭ�ӵĵ�һ��������С�����˳��Ϊ ����Ԫ�ط��Żش�
��3�����й���B2A2���Ӻ�A2D2���ӵ�˵����ȷ����
A�������ж����ЦҼ��ͦм�
B������ԭ�Ӷ�sp�ӻ�
C�����Ǻ����Լ��ͷǼ��Լ��ķǼ��Է���
D����Ϊ�ȵ�����
E��B2A2���ӵķе����Ե���A2D2����
��4��F2+����BD�����γ�[F��BD��4]2+����ԭ����BD�����к���
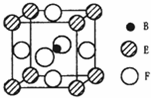 ��5����B��E��F����Ԫ���γɵ�һ�־��г����Եľ��壬������ͼ��ʾ��Bλ��E��Fԭ�ӽ��ܶѻ����γɵĿ�϶���У���һ��Fԭ�Ӿ��������Fԭ�ӵ���ĿΪ ���þ���Ļ�ѧʽΪ .���þ������Է�������ΪM�������ӵ�����ΪNA��B��E��F����Ԫ�ص�ԭ�Ӱ뾶�ֱ�Ϊr1pm��r2pm��r3pm����þ�����ܶȱ���ʽΪ ��
��5����B��E��F����Ԫ���γɵ�һ�־��г����Եľ��壬������ͼ��ʾ��Bλ��E��Fԭ�ӽ��ܶѻ����γɵĿ�϶���У���һ��Fԭ�Ӿ��������Fԭ�ӵ���ĿΪ ���þ���Ļ�ѧʽΪ .���þ������Է�������ΪM�������ӵ�����ΪNA��B��E��F����Ԫ�ص�ԭ�Ӱ뾶�ֱ�Ϊr1pm��r2pm��r3pm����þ�����ܶȱ���ʽΪ ��
 ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д� �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д� �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д� ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ҹ�ij����н����ļ���ν������ꡣ�ݻ������Ųⶨ���ó��������ļ������pHƽ��Ϊ3.2�������ֻ����е�����Ʒ���ױ���ʴ���Դ����������ĸ�ʴ����������ȷ���ǣ�
| �� | A�� | �˸�ʴ�����л�ѧ��ʴҲ�е绯ѧ��ʴ |
| �� | B�� | �����绯ѧ��ʴʱ��������ӦΪ 2H2O+O2+4e���T 4OH�� |
| �� | C�� | �ڻ�ѧ��ʴ���������������� |
| �� | D�� | �����绯ѧ��ʴʱ�ĸ�����ӦΪFe��2e���T Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±�ΪԪ�����ڱ���һ����,�����Ԫ�آ١����ڱ��е�λ��,�û�ѧ����ش��������⣺
| �� ���� | IA | 0 | ||||||
| 1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� |
��1����������Ԫ���У����������ˮ����������ǿ�Ļ�����Ļ�ѧʽ�� �����ѧ���ţ���ͬ�������������ˮ���������ǿ�Ļ�����Ļ�ѧʽ�� �����������ˮ���������Ե���������Ļ�ѧʽ�� ��
��2������ܵ���̬�⻯����ȶ����ɴ�С��˳���� ��
��3���ܡ��ݡ������Ӱ뾶�ɴ�С��˳����__________________��
��4���ڡ��ۡ��ߵ���ۺ������������ǿ������˳����______________��
��5���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ��______________��
��6���ɱ���Ԫ���γɵij�������X��Y��Z��M��N�ɷ������·�Ӧ��
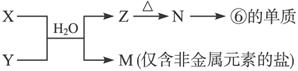
X��Һ��Y��Һ��Ӧ�����ӷ���ʽΪ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
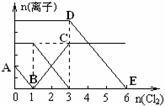 ����Fe2+��I����Br������Һ��ͨ��������������Һ�и������ӵ����ʵ����仯����ͼ��ʾ���й�˵������ȷ���� �� ��
����Fe2+��I����Br������Һ��ͨ��������������Һ�и������ӵ����ʵ����仯����ͼ��ʾ���й�˵������ȷ���� �� ��
A���߶�BC����Fe3+ ���ʵ����ı仯���
B��ԭ�����Һ��n��FeBr2���� 6mol
C����ͨ��Cl2 2molʱ����Һ���ѷ��������ӷ�Ӧ�ɱ�ʾΪ�� 2Fe2++2I��+2Cl2��2Fe3++I2+4Cl��
D��ԭ��Һ��n��Fe2+��: n��I����: n��Br������2:1:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£����ݻ�Ϊ1���ļס������������ܱ������зֱ����H2��I2�������淴Ӧ��H2��g��+I2��g��⇌2HI��g����H=-14.9kJ/mol��ʵ��ʱ�й����������
| ������� | ��ʼŨ��mol/L | ƽ��ʱ��Ũ��mol/L | ƽ��ʱ�ų�������/KJ | |
| I2 | H2 | HI | ||
| �� | 0.01 | 0.01 | 0.004 | Q1 |
| �� | 0.02 | 0.02 | a | Q2 |
�����ж���ȷ�ģ�������
A��ƽ��ʱ��������ɫ���a��0.008
B��ƽ��ʱ���ų���������Q1=1/2Q2=0.149kJ
C�����¶��£��÷�Ӧ��ƽ�ⳣ��K=4
D��ƽ���������ٳ���0.004mol HI���壬�ٴδﵽƽ��ʱHI�İٷֺ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʵļ��飬�����һ����ȷ����
A����ij��Һ�м���BaCl2��Һ��������ɫ����������HNO3��ɫ�������ܽ⣬Ҳ����������˵��ԭ��Һ��һ������SO42��
B����ij��Һ�м����������ɫ���壬��������ʹ�����ʯ��ˮ����ǣ�˵������Һ��һ������CO32�� ��SO32��
C��ȡ�������õ�Na2SO3��Ʒ���Թ��м�ˮ�ܽ⣬�ټ������ữ��Ȼ���BaCl2��Һ������HClʱ�������������BaCl2ʱ�а�ɫ����������˵��Na2SO3��Ʒ�Ѳ��ֱ�����
D����ʹʪ��ĵ⻯�ص�����ֽ������һ����Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͭ��һ����Ũ���ᷴӦ���õ�����ͭ��Һ��NO2��N2O4��NO�Ļ�����壬��Щ������1.68 L O2(��״��)��Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᡣ������������ͭ��Һ�м���6 mol��L-1NaOH��Һ��Cu2+ǡ����ȫ������������NaOH��Һ������� A.60
mL B.45 mL C.30 mL D.50 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������ε�����Һ�зֱ����ϡ����ʱ���ܲ������������������ʱ�����ܽ����_________���������ܽ����________��________������д��ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
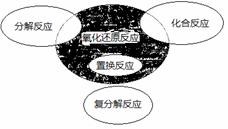
������ԭ��Ӧ�����ֻ�����Ӧ���͵Ĺ�ϵ��ͼ��ʾ�����л�ѧ��Ӧ������Ӱ���ֵ���
A��4NH3 +5O2�� 4NO + 6H2O
B��4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3
C��2NaHCO3 = Na2CO3 + H2O + CO2��
D��Cl2 + 2NaBr = 2NaCl + Br2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com