
“低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
(1)500℃时有容积为2L的密闭容器中充入2mol CO2和6mol H2,测得CO2和CH3OH的物质的量随时间变化如图所示。
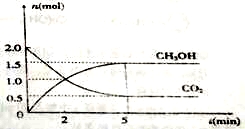
①反应的ΔS (填“>”或“<”)0,从反应开始到平衡,H2的平均反应速率:
υ(H2)=__________mol/(L·s)。
②该反应的平衡常数K=__________(保留二位有效数字);平衡时H2的转化率为________。
③将上述平衡体系的温度升高至700℃,平衡常数K=5.01,则ΔH 0(填“>”或“<”或“﹦”);为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有 __________(填序号)。
a.升高温度 b.缩小容器的容积 c.使用合适的催化剂 d.再充入CO2气体
(2)已知:①H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1257.5 kJ·mol-1
写出液态甲醇不完全燃烧生成CO气体和液态H2O的热化学方程式:
科目:高中化学 来源:2015-2016学年江西省高二上12月月考化学试卷(解析版) 题型:填空题
下图中A、D均为碳棒,B为铝棒,C为铁棒,硫酸钠溶液在实验前采取了煮沸处理。B在实验时才插入溶液中。
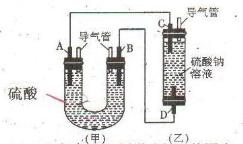
(1)从装置的特点判断,甲、乙装置中_______是原电池,负极的电极反应式为_____________________。
(2)实验开始一段时间后乙池溶液中的现象是,_______________________,若用某电解质溶液代替硫酸钠溶液也能出现相同的现象,则此溶液可以是
A.NaOH溶液 B.AgNO3溶液
C.NaCl溶液 D.CuSO4溶液
(3)实验前煮沸硫酸钠溶液的目的是______________________________ 。
(4)在实验(2)的基础上,改变两电极的连接方式,A接D、B接C,此时D电极上的电极反应式为_________________。乙装置里除两电极有明显现象外,还可以看到的现象是________________________,产生该现象的化学方程式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:选择题
化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
C.向硝酸银溶液中加入同浓度的氯化钠和溴化钠溶液,先产生浅黄色沉淀,则Ksp(AgBr)>Ksp(AgCl)
D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷(解析版) 题型:选择题
下列说法不正确的是
A.焓变是判定一个反应能否自发进行的相关因素,多数放热反应能自发进行
B.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
C.自发进行的反应一定能迅速进行
D.一个反应能否自发进行,与焓变和熵变的共同影响有关
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷(解析版) 题型:选择题
有关化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ): N N键为942、O=O键为500、O—H键为463,则断裂1 molNH3中N—H键所需的能量是
N键为942、O=O键为500、O—H键为463,则断裂1 molNH3中N—H键所需的能量是
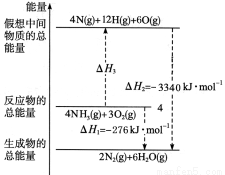
A.658 B.516 C. 391 D. 194
查看答案和解析>>
科目:高中化学 来源:2016届广西河池市高三上第五次月考理综化学试卷(解析版) 题型:选择题
生活中的一些问题常涉及到化学知识,下列叙述正确的是
A.氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应
B.明矾和漂白粉常用于自来水的处理,两者的作用原理相同
C.氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应
D.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+ cCl2↑+ d HClO4 +eH2O。下列有关说法不正确的是
A.还原产物只有Cl2
B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:
3HClO3 =2O2↑+ C12↑+ HClO4 + H2O
C.由非金属性Cl>S,可推知酸性HClO3>H2SO4
D.若化学计量数a=8,b=3,则该反应转移电子数为20
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上月考化学试卷(解析版) 题型:填空题
(除标注外,每空2分,共8分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是__ __。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是__ _。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:
____。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值。涉及反应如下(均未配平):
NiOOH+Fe2++H+——Ni2++Fe3++H2O
Fe2++MnO +H+——Fe3++Mn2++H2O
+H+——Fe3++Mn2++H2O
则x=____;y=__。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH = -221 kJ·mol-1 ,②稀溶液中,H+(aq)+OH-(aq) =H2O(l) ΔH = -57.3 kJ·mol-1。由此可以推断下列结论正确的是
A.稀硫酸与稀氨水溶液反应生成1 mol水,放出57.3 kJ热量
B.①的焓变为221 kJ·mol-1
C.浓硫酸与稀NaOH溶液完全反应生成1 mol水时放热为57.3 kJ
D.1mol碳完全燃烧放出的热大于110.5 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com