
【题目】在某澄清透明的酸性溶液中,能共存的离子组是( )
A.NH4+、Cl﹣、Fe2+、K+B.Na+、CO32﹣、K+、Cl﹣
C.Cl﹣、Ba2+、Na+、SO42﹣D.K+、SO42﹣、OH﹣、Na+
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】回答下列各小题中的问题,请用“>”“<”或“=”填空。
(1)质量相同的下列各组物质,所含“物质的量”关系是:
①CO________CO2;
②H2SO4________H3PO4。
(2)相同物质的量的下列各组物质,比较其质量的大小:
①HCl________HF;
②HNO3________H3PO4;
③Mg________Al;
④Na+________Al3+。
(3)比较分子数目多少:
①9 g H2O________11 g CO2;
②1 g H2________1 g O2。
(4)比较下列物质中氢原子数目多少:
①4.9 g H2SO4________5.4 g H2O;
②1.6 g CH4________0.4 g H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)
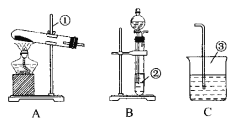
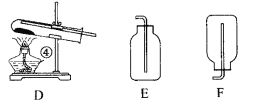
(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.用量筒量取 5mL 蒸馏水
B.用分液漏斗分离乙醇和水
C.用托盘天平称量 NaCl 固体 5.8g
D.用 pH 试纸测氯水的 pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( ) 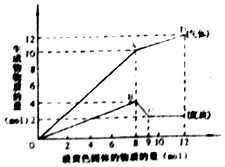
A.溶液中一定含有Mg2+、NH4+、Al3+ , 可能含有Fe2+
B.图中A点产生的气体总质量为230克
C.图中A到D之间会产生有刺激性气味的气体
D.图中B到C之间发生的化学反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣HCO3﹣等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
(1)火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示: 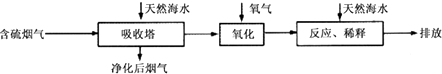
(i)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因 .
(ii)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(iii)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).
(iv)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为 , 所得溶液中c(H+)﹣c(OH﹣)=(填字母编号).
A.c(SO32﹣)﹣c(H2SO3) B.c(SO32﹣)+c(NH3 . H2O)﹣c(H2SO3)
C.c(HSO3﹣)+c(SO32﹣)﹣c(NH4+) D.c(HSO3﹣)+2c(SO32﹣)﹣c(NH4+)
(2)重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10﹣17 | 5.6×10﹣8 | 6.3×10﹣50 | 7.1×10﹣9 | 1.2×10﹣15 | 3.4×10﹣28 |
(i)你认为往废水中投入(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(ii)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= .
(iii)如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1gmL﹣1).若环境要求排放标准为c(Ag+)低于1.0×10﹣8mol/L,问该工厂处理后的废水中c(Ag+)= . (已知KSP(AgCl)=1.8×10﹣10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用FeCl3溶液腐蚀铜板:Fe3++Cu═Fe2++Cu2+
B.向氨水中通入过量SO2:SO2+2NH3?H2O═2NH4++SO32﹣+H2O
C.用MnO2与浓盐酸反应制Cl2:MnO2+4HCl ![]() ?Mn2++2Cl﹣+Cl2↑+2H2O
?Mn2++2Cl﹣+Cl2↑+2H2O
D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3+4OH﹣═2FeO43﹣+3Cl﹣+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A. 加热后溶液颜色变为无色
加热后溶液颜色变为无色
B.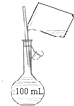 配制100 mL 0.10 molL﹣1NaCl溶液
配制100 mL 0.10 molL﹣1NaCl溶液
C. 实验室用该装置制取少量蒸馏水
实验室用该装置制取少量蒸馏水
D. 称量25 g NaOH
称量25 g NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOHCH3COO﹣+H+ , 要使溶液中 ![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液
B.降低温度
C.加少量冰醋酸
D.加水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com