
| A. | 标准状况下,4.48 L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4 g SO2中含有的氧原子数目为0.2NA | |
| C. | 1 L 0.1 mol•L-1 K2CO3溶液中含有的钾离子数目为0.1 NA | |
| D. | 100 mL 1.0 mol•L-1 FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |
分析 A、标况下乙醇为液态;
B、求出二氧化硫的物质的量,然后根据1mol二氧化硫中含2mol氧原子来分析;
C、求出碳酸钾的物质的量,然后根据1mol碳酸钾中含2mol钾离子来分析;
D、求出氯化铁的物质的量,然后根据铁离子与铜反应后变为+2价来分析.
解答 解:A、标况下乙醇为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、6.4g二氧化硫的物质的量为0.1mol,而1mol二氧化硫中含2mol氧原子,故0.1mol二氧化硫中含0.2NA个氧原子,故B正确;
C、溶液中碳酸钾的物质的量n=CV=0.1mol/L×1L=0.1mol,而1mol碳酸钾中含2mol钾离子,故0.1mol碳酸钾中含0.2NA个钾离子,故C错误;
D、溶液中氯化铁的物质的量n=CV=1mol/L×0.1L=0.1mol,含0.1mol铁离子,而铁离子与铜反应后变为+2价,故0.1mol铁离子反应后转移0.1NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
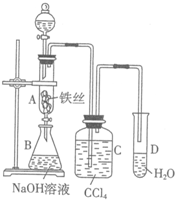 某化学课外小组用图装置制取溴苯.
某化学课外小组用图装置制取溴苯. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①中产生的气体为氨,并可得原溶液中c(NH4+)=0.1 mol•L-1 | |
| B. | 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2 | |
| C. | 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证 | |
| D. | 原溶液中一定含有Na+,且c(Na+)≥0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△}^{氧化/催化剂}$
$→_{△}^{氧化/催化剂}$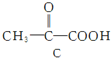 $→_{△}^{H_{2}/Ni}$
$→_{△}^{H_{2}/Ni}$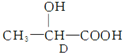
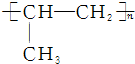 .
.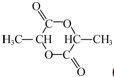 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
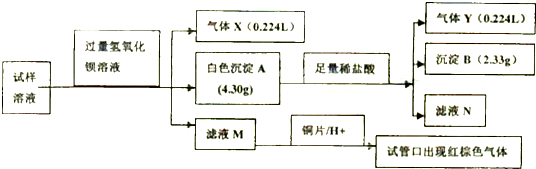
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com