
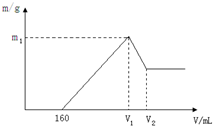
 将镁和铝的混合物0.1mol溶于100ml 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:分析 (1)Al、NaOH、水反应生成偏铝酸钠和氢气,Al、水、氢气在离子反应中保留化学式,以此来解答;
(2)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=160mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,根据Mg原子、Al原子、SO42-离子、Na+离子守恒,列方程求算n(Mg);当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据SO42-离子、Na+离子和Al原子守恒,求出n(NaOH),再利用V=$\frac{n}{c}$计算;
(3)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4)求出n(NaOH),再利用V=$\frac{n}{c}$计算;
(4)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL2mol•L-1硫酸溶解后,再加入450mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,求得:Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1.
解答 解:(1)金属铝与氢氧化钠溶液反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.16L×1mol/L=0.08mol
令MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42-离子守恒有:x+3y=0.2-0.08
联立方程,解得:x=0.06;y=0.02
所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L×+0.04mol=0.44mol,
所以,V2=$\frac{0.44mol}{1mol/L}$=0.44L=440ml
故答案为:0.06;440;
(3)当溶液中Mg2+、Al3+恰好沉淀完全时,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,V(NaOH)=$\frac{0.4mol}{1mol/L}$=0.4L=400ml
故答案为:400;
(4)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL2mol•L-1硫酸溶解后,再加入450mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3 +NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1,
故答案为:0.5≤a<1.
点评 对于图象分析题的解题规律:要明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析.注意守恒思想的运用,使计算简化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| B. | Na2CO3溶液中:c(Na+)<2c(CO32-)+c(HCO3-) | |
| C. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4Cl)>c[(NH4)2SO4] | |
| D. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应含有a | B. | 只含有b | C. | 比含有c | D. | 一定有a、b、c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铝与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| C. | NO2和NO的混合气体中,NO的体积分数是20% | |
| D. | 得到19.4g沉淀时,加入NaOH溶液的体积是300mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:7 | B. | 7:1 | C. | 5:3 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 NaCl
NaCl .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数是99 | B. | 质量数是43 | C. | 质子数是56 | D. | 中子数是56 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com