
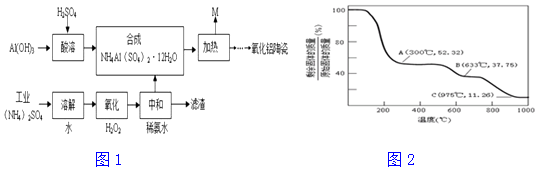
分析 制备透明氧化铝陶瓷的工艺流程:Al(OH)3、H2SO4发生反应为2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O;工业(NH4)2SO4(含FeSO4)溶于水,然后向溶液中加入双氧水,双氧水具有氧化性、硫酸亚铁具有还原性,二者发生氧化还原反应生成铁离子和水,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,将得到的溶液中加入氨水,调节溶液的pH,使铁离子转化为Fe(OH)3沉淀,然后过滤得到滤渣;将滤液加入硫酸铝溶液中,通过分离得到固体NH4Al(SO4)2•12H2O,加热固体NH4Al(SO4)2•12H2O,该物质分解生成M和含铝物质,
(1)硫酸铵中含有硫酸亚铁,亚铁离子被双氧水氧化成铁离子;
(2)根据NH4++H2O?NH3•H2O+H+,K=$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$=$\frac{c(O{H}^{-})•c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})•c(O{H}^{-})}$=$\frac{{K}_{W}}{{K}_{b}(N{H}_{3}•{H}_{2}O)}$,据此解答;
(3)的杂质离子是铁离子,铁离子用KSCN溶液检验;
(4)NH4Al(SO4)2溶液与过量NaOH溶液反应生成氨气和偏铝酸钠;
(5)M的主要成分的化学式是NH3、H2O、SO3 ;可以用浓硫酸吸收生成硫酸铵,以便重复利用;
(6)633℃时剩余固体质量分数是反应前的37.75%,根据硫酸铝铵晶体分解情况分析,得出化学式.
解答 解:(1)亚铁离子被氧化双氧水成铁离子,根据化合价升降相等配平方程式,离子方程式是:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)铵根离子水解,NH4++H2O?NH3•H2O+H+,故(NH4)2SO4溶液呈酸性,该反应的K=$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$=$\frac{c(O{H}^{-})•c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})•c(O{H}^{-})}$=$\frac{{K}_{W}}{{K}_{b}(N{H}_{3}•{H}_{2}O)}$=$\frac{1.0×1{0}^{-14}}{1.75×1{0}^{-5}}$=5.7×10-10;
故答案为:NH4++H2O?NH3•H2O+H+,5.7×10-10;
(3)中和液中的杂质离子是铁离子,铁离子用KSCN溶液检验,其检验方法为取少量中和后的溶液,滴加KSCN溶液,若溶液不变红,则已完全除去;若溶液变红,则未除尽;
故答案为:取少量中和后的溶液,滴加KSCN溶液,若溶液不变红,则已完全除去;若溶液变红,则未除尽;
(4)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为:NH4Al(SO4)2+5NaOH $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+3H2O+NaAlO2+2Na2SO4;
故答案是:NH4Al(SO4)2+5NaOH $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+3H2O+NaAlO2+2Na2SO4;
(5)根据(6),流程图中M的主要成分的化学式为NH3、H2O、SO3 ;可以用浓硫酸吸收生成硫酸铵重复使用;
故答案是:NH3、H2O、SO3 ; 浓硫酸
(6)假设有1mol硫酸铝铵晶体,摩尔质量是453g/mol,质量是453g,最后得到的是氧化铝,硫酸铝铵晶体加热过程中会分解,分别生成了水、氨气、三氧化硫;
当结晶水完全失去时,剩余固体与原始固体的质量百分比是:$\frac{18×12}{453}$×100%≈52.32%,大于这个值,说明结晶水没有完全失去;
当温度继续升高,硫酸铝铵中的硫酸铵开始分解生成氨气和三氧化硫,硫酸铵完全分解时,剩余物为硫酸铝,剩余固体与原始固体的质量百分比是:$\frac{171}{453}$×100%≈37.75%;当比值大于37.75%时,硫酸铵没有完全分解,当等于这个比值,说明硫酸铵恰好分解完全,小于这个比值,硫酸铝开始分解;故B点剩余固体是硫酸铝;
故答案是:Al2(SO4)3.
点评 本题考查物质制备实验方案评价,为高频考点,侧重考查学生分析、推断、计算能力,明确流程图中发生的反应及基本操作是解本题关键,难点有关计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
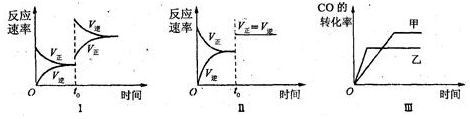
| A. | 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响 | |
| B. | 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响 | |
| C. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 | |
| D. | 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2反应速率3 mol•l-1•min-1 | B. | N2反应速率0.3 mol•l-1•s-1 | ||
| C. | H2反应速率0.3mol•l-1•s-1 | D. | NH3反应速率0.4mol•l-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 干法 | Fe2O3、KNO3、KOH 混合加热共熔生成紫红色 K2FeO4 和 KNO2 等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3和 KClO 反应生成紫红色 K2FeO4溶液 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2中所含的中子数为42NA | |
| B. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| C. | 2mol•L-1的FeCl3溶液溶液中含有的Fe3+数目小于2NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30gNO和30gSiO2中含有的氧原子数均为NA | |
| B. | 0.5L2.0mol•L-1NaHSO3溶液中含有的HSO3-数目为NA | |
| C. | 标准状况下,5.6LN2与足量的H2反应生成NH3转移的电子数为1.5NA | |
| D. | 标准状况下,11.2LNH3与11.2LHCl混合后所得气体中分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
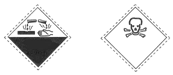
| A. | 腐蚀性、有毒 | B. | 自燃物品、易燃 | C. | 爆炸性、腐蚀性 | D. | 氧化剂、有毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CO2 的质量为44g/mol | |
| B. | CO2的摩尔质量为44g | |
| C. | 1 mol CO2的质量与CO2的相对分子质量在数值上相同 | |
| D. | CO2的摩尔质量等于CO2的相对分子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com