
【题目】如图中的曲线是表示其他条件一定时,2NO(g)+O2(g) ![]() 2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
A.a点
B.b点
C.c点
D.d点
【答案】C
【解析】转化率一定的点表示平衡状态,所以a、b点在曲线上,所以表示平衡状态,而c点的NO的转化率低于平衡转化率,说明未达平衡状态,且反应正向进行,所以v(正)>v(逆);而d点对应的NO的转化率大于平衡时的转化率,则平衡逆向移动,所以v(正)<v(逆),则符合题意的点是c点。
所以答案是:C
【考点精析】本题主要考查了化学平衡状态的判断的相关知识点,需要掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能正确解答此题.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】常温下氨气能被氯气氧化成N2,化工厂常用浓氨水检验管道是否泄漏氯气。某兴趣小组在实验室对氨气与氯气反应进行了探究,回答下列问题:
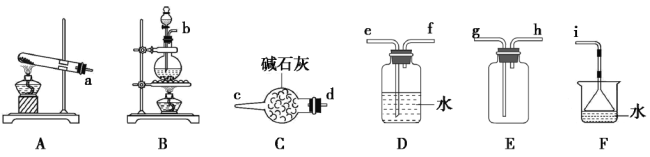
(1)氯气的发生装置可以选择上图中的_________(填大写字母),反应的离子方程式为________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________(按气流方向,用小写字母表示)。
II.氯气与氨气的反应
室温下,用收集到的氯气与氨气按下图所示装进行实验(实验前K1、K2关闭)。

(3)为使两种气体充分混合,气体a是___________(填化学式)。
(4)
操作步骤 | 实验现象 | 解释原因 |
打开K1,缓缓推动注射器活塞,向试 管中注入气体a (约是气体b的3倍), 关闭K1,恢复室温 | 试管内出现白烟并在 试管内壁凝结 | ①反应的化学方程式________ |
打开K2 | ②_________ | ③_________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiS 可用作陶瓷和搪瓷的着色剂。NiS 在有水存在时能被氧气氧化成Ni(OH)S。将H2S通入稀硫酸酸化的NiSO4溶液中,经过过滤,制得NiS 沉淀,装置如图所示:

下列对实验的叙述正确的是
A. 在装置A中滴加蒸馏水前通入N2,是为了将H2S赶入C 装置中与NiSO4溶液反应
B. 装置B 中盛放浓硫酸
C. 装置D 中的洗涤液应用煮沸过的蒸馏水
D. 反应结束后继续通入N2 可将C装置中产生的沉淀压入过滤沉淀漏斗中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写错误的是( )
A.HCl=H++Cl-B.H2SO4=2H++SO42-
C.CaCl2=Ca2++2Cl-D.NaOH=Na++O2- +H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光催化技术是一种在能源和环境领域有着重要应用前景的绿色技术。Ti的某种晶型的氧化物M可用作光催化材料。
(1)基态Ti原子的价层电子排布图为________。
(2)在第四周期d区元素中,与Ti 原子未成对电子数相同的元素名称是________。
(3)金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为_____。

(4)生活环境中的臭气源有氨气、甲硫醇(CH3-SH) 等,M 可以作为高效除臭剂。与氨气互为等电子体的阳离子为_____,甲硫醇中硫原子采取的杂化方式为_____,与S位于同一周期,且第一电离能小于S 的非金属元素符号为______,已知甲硫醇熔沸点小于甲醇(CH3OH),试解释此差异的主要原因___________。
(5)M 的晶胞结构如图2,M 化学式为______。
(6)石墨烯是单个原子厚度的二维碳纳米材料( 如图3),其比表面积大( 比表面积指单位质量物料所具有的总面积)。石墨烯与M 的结合使用,极大地提高了M 的光催化效果。在石墨烯晶体中,每个最小的六元环占有____个C 原子。已知石墨烯中C-C 键长为a pm,则单层石墨烯的比表面积为_____m2/g(NA表示阿伏伽德罗常数的数值,忽略碳原子的厚度)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
A. 当HI、H2、I2浓度之比为2:1:1时,说明该反应达平衡
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.放电时负极附近溶液的碱性不变
B.充电过程是化学能转化为电能的过程
C.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣═NiOOH+H2O
D.放电时电解质溶液中的OH﹣向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A.该反应正反应为吸热反应
B.达平衡时,甲、乙容器内:2c(CO2 , 甲)<c(CO2 , 乙)
C.达平衡时,容器甲中的逆反应速率比容器乙中的大
D.达平衡时,转化率:a(CO2 , 甲)+a(C2H5OH,丙)>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B是生活中常見的有机物, E的产量是石油化工发展水平的标志.根据下面转化关系回答下列问题:
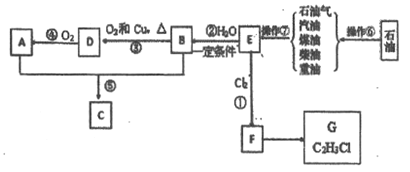
(1)在①~⑤中原子利用率为100%的反应是_____(填序号)。
(2)操作⑥、操作⑦的名称分別为_____、______。
(3)写出反应③的化学方程式________。
(4)写出反应⑤的化学方程式_________。
(5)G可以发生聚合反应生产塑料,其化学方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com