
 运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 4.48L |
| 22.4L/mol |
| 0.112L |
| 22.4L/mol |
| 0.01mol |
| 0.1L |
| 10-14 |
| 0.1 |


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:不详 题型:填空题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学知识解决生产、生活中的有关问题备受关注。请回答下列问题:
(1)已知水存在如下平衡:H2O![]() H++OH- △H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是 。
H++OH- △H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是 。
A. 向水中加入NaHSO4固体 B. 向水中加Na2CO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯。当400mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
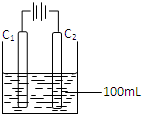
 (4)实验室中采用惰性电极模拟工业上电解饱和食盐水的过程:
(4)实验室中采用惰性电极模拟工业上电解饱和食盐水的过程:
①写出C1电极上发生反应的电极反应式 。
②当C2电极上产生112mL(标准状况)气体时(假设气体完全
逸出,溶液体积不变),烧杯中溶液的pH= 。(Kw=10-14)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济南外国语学校高三(上)期中化学试卷(解析版) 题型:填空题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com