
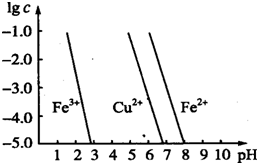
 铁、氯、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题.
铁、氯、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题.| c(ClO2-) |
| c(HClO2) |
| c(H+)c(ClO2-) |
| c(HClO2) |
| c(ClO2-) |
| c(HClO2) |
| K |
| c(H+) |
| 1.0×10-2 |
| 10-5 |
| 6.3×10-18 |
| 10-5 |


科目:高中化学 来源: 题型:
| A、将少量SO2气体通入氨水中:SO2+NH3?H2O═NH4++HSO3- |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-═NO3-+H2O |
| D、向稀硫酸加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)有如图所示A、B、C、D四种仪器:请选择下列仪器名称的序号,填入相应的空格内:
(1)有如图所示A、B、C、D四种仪器:请选择下列仪器名称的序号,填入相应的空格内:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②③ | C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ |
| B、Al3+ |
| C、Cu2+ |
| D、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )| A、Ⅱ表示的是滴定盐酸的曲线 |
| B、PH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| C、V(NaOH)=20mL时,C(Cl- )═C(CH3COO- ) |
| D、V(NaOH)=10mL时,醋酸溶液中:C(Na+ )>C(CH3COO- )>C(H+ )>C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
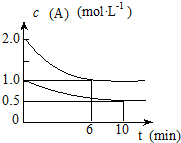 容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)═xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)═xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )| A、甲容器中A的反应速率为0.1mol/L?min |
| B、给甲容器加压可缩短反应达到平衡的时间 |
| C、给乙容器升温可缩短反应达到平衡的时间 |
| D、甲和乙的平衡转化率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com