
分析 电解氢氧化钠溶液,阳极氢氧根离子放电,生成氧气,阴极氢离子放电,生成氢气,实质为电解水,以此解答该题.
解答 解:电解NaOH溶液,氢氧根离子在阳极上失电子生成氧气,其电极方程式为:4OH--4e-=O2↑+2H2O;氢离子在阴极上得电子生成氢气,其电极方程式为:2H++2e-=H2↑;则电解总方程为:2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑;溶液中氢氧化钠的物质的量不变,水的体积减小,所以氢氧化钠的浓度逐渐增大,氢氧根离子的浓度逐渐增大,所以溶液的pH增大,如挥发原浓度,可加入适量的水.
故答案为:2H++2e-=H2↑;4OH--4e-=O2↑+2H2O;增大;增大;加入适量的水.
点评 本题考查了电解池原理的应用,题目难度中等,明确阴阳极上离子的放电顺序即可解答,注意把握常见物质的电解方程式,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
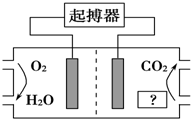 如图所示,最近美国医学家利用人体自身环境设计了心脏起搏器,其动力由人体体液中的能量物质提供.下列有关说法正确的是( )
如图所示,最近美国医学家利用人体自身环境设计了心脏起搏器,其动力由人体体液中的能量物质提供.下列有关说法正确的是( )| A. | 图中“?”为人体中的脂肪 | |
| B. | O2极为心脏起搏器的负极 | |
| C. | 产生的CO2使人体血液呈酸性,长期使用对人体有害 | |
| D. | 电池正极的电极反应式为O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的CO2通入Na2SiO3溶液中 | |
| B. | 向AlCl3溶液中滴加稀氨水至过量 | |
| C. | 少量的CO2通入BaCl2溶液中 | |
| D. | 向FeCl3溶液中滴加NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X是一种常见气态烃,它可由乙醇与浓硫酸加热到170℃制得.现以X为主要原料合成一种具有果香味的环状物质A,其合成路线如图所示.其中③、④的催化剂等条件不同;又已知RBr在碱性条件下水解生成ROH.
X是一种常见气态烃,它可由乙醇与浓硫酸加热到170℃制得.现以X为主要原料合成一种具有果香味的环状物质A,其合成路线如图所示.其中③、④的催化剂等条件不同;又已知RBr在碱性条件下水解生成ROH. +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com