
| A、0.1 mol?L-1 NaOH溶液与0.2 mol?L-1 CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.1mol?L-1 |
| B、常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c (CH3COOH) |
| C、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③ |
| D、25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=13 |


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| B、NaHCO3溶液中:c(Na+)+c(H-)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、NH4Cl溶液中:c(NH4+)>o(Cl-)>c(OH-)>c(H+) |
| D、CH3COOK溶液中:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成物质的分子中一定含有化学键. |
| B、离子化合物可能含有共价键 |
| C、共价化合物可能含有离子键 |
| D、离子化合物中一定含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
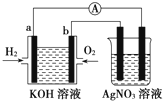 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li | B、Na | C、K | D、Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com