
������һ��ǿ�ᣬŨ�ȳ���40��ʱ�ᷢ���ֽ⣬��Ӧ�ɱ�ʾΪ
a HClO3 = bO2��+ c Cl2��+ d HClO4 + e H2O�������й�˵������ȷ����
A���ɷ�Ӧ��ȷ����������HClO3��O2
B��������ֽ����û�����壬lmol�����������Ϊ45g����Ӧ����ʽ�ɱ�ʾΪ��3HClO3 = 2O2��+ C12��+ HClO4 + H2O
C���ɷǽ�����Cl��S������֪����HClO3��H2SO4
D������ѧ������a=8��b=3����÷�Ӧת�Ƶ�����Ϊ20e��
C
��������
���������A������HClO3�������������ǻ�ԭ����HClO4��O2���������Cl2�ǻ�ԭ�����������������ǿ�����������A��ȷ��B�������ɵ�Cl2��O2�Ļ������ƽ��������Ϊ45����n(O2)��32g/mol+n(Cl2)��71g/mol��[n(O2)+n(Cl2)] =45g/mol����n��O2����n��Cl2��=2��1���ɵ����غ�û�ѧ��Ӧ����ʽΪ3HClO3=2O2��+Cl2��+HClO4+H2O����B��ȷ��C���ȽϷǽ�����ǿ����ӦΪ��ۺ���������ԣ�ӦΪHClO4��H2SO4����C����D������ѧ������a=8��b=3����C�����ɵû�ѧ��Ӧ����ʽΪ8 HClO3=3O2��+2 Cl2��+4 HClO4+2H2O������ת����ĿΪ20e-����D��ȷ��
���㣺���⿼��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��ɽ�и���9�¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��������(NF3)�����ӹ�ҵ�������ĵ����ӿ�ʴ���壬���ڳ�ʪ�Ļ������ܷ�����Ӧ��3NF3��5H2O=2NO��HNO3��9HF�������й�˵����ȷ����
A��NF3���������������ǻ�ԭ��
B����ԭ���������������ʵ���֮��Ϊ2��1
C��������0.2 mol HNO3����ת��0.2 mol����
D��NF3�ڳ�ʪ�Ŀ�����й©�������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��ɽ�е���У����������һѧ�ڻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ϡ��Ԫ���ֳơ���ʮһ���ͻƽ𡱣�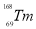 ��
��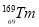 ��
��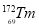 ����ϡ��Ԫ�أ�����Tm��������ָ������Ҫ��Դ������ʽX����������˵������ȷ���ǣ� ��
����ϡ��Ԫ�أ�����Tm��������ָ������Ҫ��Դ������ʽX����������˵������ȷ���ǣ� ��
A��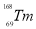 ��
��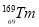 ��Ϊͬλ�� B��
��Ϊͬλ�� B��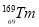 ��
��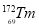 �Dz�ͬ�ĺ���
�Dz�ͬ�ĺ���
C��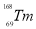 ��
��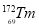 �����������4 D��
�����������4 D��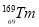 ��
��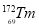 �ĵ��������3
�ĵ��������3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��У������ѧ�ڵ�һ���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ��������ܴﵽԤ��ʵ��Ŀ�ĵ���
| ʵ��Ŀ�� | ʵ����� |
A | ����CO32-�� SO42- | �ֱ���뱥��CaCl2��Һ |
B | �Ƚ�Al��Fe�Ľ������ | �ֱ����ŨNaOH��Һ |
C | �Ƚϱ��Ӻ���������� | �ֱ����NaHCO3��Һ |
D | �Ƚ�AgCl��AgI���ܽ�� | ��AgCl�ı���Һ�м�����KI��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��У������ѧ�ڵ�һ���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A��������ά���л�������̼��ά�������л��߷��Ӳ���
B�������ʵ�ˮ����ﶼ�����Ȼ����ǻ�
C������ï���䶯һʱ��PX(���Զ��ױ�)���ڷ��������������ڱ���ͬϵ��
D���ҹ����Һ�ĸ���������������ڽ��ػ�����������������ָ��£����ڽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ɽ��ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ȷ��ʾ���з�Ӧ�����ӷ�Ӧ����ʽΪ
A������ʯ���ڴ�����Һ�� CaCO3 + 2H+==Ca2+ + CO2 ��+ H2O
B����FeBr2��Һ��ͨ������������2Fe2+ + 4Br- + 3Cl2=== 2Fe3+ + 2Br2 + 6Cl-
C��NH4HCO3���ڹ�����NaOH��Һ�У� HCO3- + OH- === CO32- + H2O
D����������KAl(SO4)2��12H2O����Һ�еμ�Ba(OH)2��Һ��ǡ��ʹSO42-������ȫ��2Al3+ + 3SO42- + 3Ba2+ + 6OH-=== 2Al(OH)3�� + 3BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ɽ��ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڶ������У�Rԭ���������������������������3��������˵������ȷ����
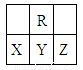
A��ԭ�Ӱ뾶��С��X>Y>Z
B���⻯����ȶ��ԣ�X>Y
C��������YR2��ʹƷ����Һ��ɫ
D��X��Y��Z����Ԫ������������ˮ�����������ǿ����Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ɽ��ʡ������ѧ�ڵڶ����¿�������ѧ�Ծ��������棩 ���ͣ�ѡ����
���и�����������Һ���ܹ��������棬�Ҽ����������ֻ�������ų�����
A��H+��Al3+��Cl‑��SO32- B��Na+��K+��OH‑��[Al(OH)4]-
C��H+��K+��SO42-��NO3‑ D��Na+��NH4+��Cl-��OH‑
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ɽ��ʡ�����и�����ѧ������������ѧ�Ծ���A���������棩 ���ͣ�ѡ����
�������ƣ�Na2FeO4����һ�����͡���Ч�����ˮ���������DZ�Cl2��O3��ClO2��KMnO4�����Ը�ǿ��������Ⱦ����ɫˮ����������ҵ�Ƹ������Ƶķ������������֣�
ʪ���Ʊ�����Ҫ���ӷ�ӦΪ��2Fe(OH)3 +3ClO��+4OH�� = 2FeO42�� +3Cl��+5H2O ,
�ɷ��Ʊ�����Ҫ��Ӧ����Ϊ��2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2��
�������й�˵������ȷ����
A����������������+6��
B��ʪ����FeO42������������
C���ɷ���ÿ����1mol Na2FeO4 ת��4mol����
D��K2FeO4������ˮ�е�H2S��NH3�����ɵ�Fe(OH)3���廹��������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com