
 取6根铁钉,6支干净的试管及其他材料,如图所示.
取6根铁钉,6支干净的试管及其他材料,如图所示.分析 (1)金属的电化学腐蚀是因为形成原电池装置的腐蚀,金属是负极,发生氧化反应;
(2)金属生锈的条件:金属和空气中的氧气、水(电解质)以及不活泼金属杂质存在,构成原电池装置;
(3)金属和的防护方法:让金属隔绝空气,或是让金属做原电池的正极或是电解池的阴极.
解答 解:(1)金属的电化学腐蚀是因为形成原电池装置的腐蚀,述实验中铁钉发生了电化学腐蚀的是①④⑥,金属铁是负极,发生氧化反应,Fe-2e-═Fe2+.故答案为:①④⑥;Fe-2e-═Fe2+;
(2)金属和空气中的氧气、水(电解质)以及不活泼金属杂质存在,构成原电池装置,这些是引起和促进铁钉被腐蚀的条件,故答案为:水、空气、电解质溶液和不活泼金属杂质的存在;
(3)为防止铁的锈蚀,可以在表面涂上油漆、搪瓷、沥青等或镀上不易生锈的合金或牺牲阳极保护法,故答案为:在表面涂上油漆、搪瓷、沥青等或镀上不易生锈的合金或牺牲阳极保护法(答出其中两种即可).
点评 本题主要考查了金属生锈的条件和金属的防护方面的知识,注意知识的迁移应用和归纳总结是关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②③④ | C. | ②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
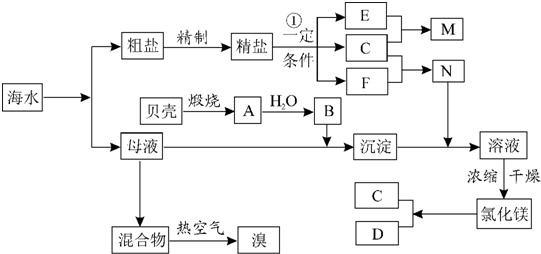
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL 3 mol•L-1的NaHCO3溶液 | B. | 20℃30mL 2 mol•L-1的NaHCO3溶液 | ||
| C. | 20℃10mL 4 mol•L-1的NaHCO3溶液 | D. | 10℃10mL 2 mol•L-1的NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理不同 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
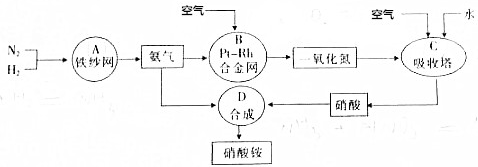
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:Y<X | B. | 简单离子半径:Y<Z | ||
| C. | 盐M的水溶液显酸性 | D. | 最高化合价:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.4g CO2物质的量为0.1mol | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.1mol | |
| C. | 标准状况下,1NA个H2O分子含有氧分子数为1mol | |
| D. | 标准状况下,22.4L酒精的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
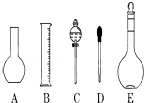 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com