
A.若c>b - a,则 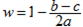 |
B.若a + c>b,则 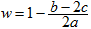 |
| C.若b="a" + c,则 w=0.5 |
D.若a<b-c,则  |
 2HCl;②HCl+NaOH=NaCl+H2O;③ Cl2+2NaOH ="NaCl+" NaClO+H2O。混合气体中氯气的物质的量为awmol。因为最终溶液中含有c molNaClO(c>0)说明Cl2对于H2来说是过量的。则根据③可知消耗Cl2的物质的量为cmol;消耗NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为(aW-c)mol,H2的物质的量为(a-aW)mol。产生的HCl的物质的量为2(aW-c)mol.其消耗的NaOH的物质的量为2(aW-c)mol。若恰好完全反应。则b="2c+2(aW-c)" , (aw-c)mol=(a-aW)mol。2aw=a+c.钠元素的存在形式NaCl、NaClO。b= 2aw。即恰好完全反应时b=a+c。当a+c >b, 即c>b – a时,对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH不足量,n(NaClO)=cmol,消耗的NaOH的物质的量为2cmol,反应②消耗的NaOH的物质的量为(b-2c)mol。HCl的物质的量为(b-2c)mol,由于①反应Cl2过量,所以n(H2)= (b-2c)/2mol.。n(Cl2)=" a-(b-2c)/2mol" ="(2a-b+2c)" /2mol.所以氯气的体积分数w= n(Cl2)÷n(总)= (2a-b+2c)/2mol÷amol=
2HCl;②HCl+NaOH=NaCl+H2O;③ Cl2+2NaOH ="NaCl+" NaClO+H2O。混合气体中氯气的物质的量为awmol。因为最终溶液中含有c molNaClO(c>0)说明Cl2对于H2来说是过量的。则根据③可知消耗Cl2的物质的量为cmol;消耗NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为(aW-c)mol,H2的物质的量为(a-aW)mol。产生的HCl的物质的量为2(aW-c)mol.其消耗的NaOH的物质的量为2(aW-c)mol。若恰好完全反应。则b="2c+2(aW-c)" , (aw-c)mol=(a-aW)mol。2aw=a+c.钠元素的存在形式NaCl、NaClO。b= 2aw。即恰好完全反应时b=a+c。当a+c >b, 即c>b – a时,对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH不足量,n(NaClO)=cmol,消耗的NaOH的物质的量为2cmol,反应②消耗的NaOH的物质的量为(b-2c)mol。HCl的物质的量为(b-2c)mol,由于①反应Cl2过量,所以n(H2)= (b-2c)/2mol.。n(Cl2)=" a-(b-2c)/2mol" ="(2a-b+2c)" /2mol.所以氯气的体积分数w= n(Cl2)÷n(总)= (2a-b+2c)/2mol÷amol=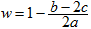 .因此A错误;B正确。C.若b="a" + c,H2和Cl2不仅发生①反应,还发生③反应都则 w>0.5。错误。D. 若a+c<b,即a<b-c则对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH过量,n(NaClO)="cmol" ,该反应消耗的NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为 (aw-c)mol, H2的物质的量为(a-aw)mol. (aw-c) =(a-aW),2aw=a+c,
.因此A错误;B正确。C.若b="a" + c,H2和Cl2不仅发生①反应,还发生③反应都则 w>0.5。错误。D. 若a+c<b,即a<b-c则对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH过量,n(NaClO)="cmol" ,该反应消耗的NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为 (aw-c)mol, H2的物质的量为(a-aw)mol. (aw-c) =(a-aW),2aw=a+c, 。正确。2和Cl2的混合气体光照后被NaOH溶液吸收时各种物质的相对量的多少的知识。
。正确。2和Cl2的混合气体光照后被NaOH溶液吸收时各种物质的相对量的多少的知识。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为5NA |
| B.标准状况下,5.6 L氧气中含有O的总数为0.5NA |
| C.25℃时,pH=13的Ba(OH)2溶液1.0L中含有OH-总数为0.1NA |
| D.20 g重水(D2O)中所含电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
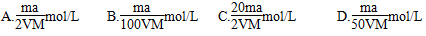
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,1 mol Cl2与足量NaOH溶液完全反应,转移的电子数2NA |
| B.常温常压下,11.2 L CO2中含有的分子数是0.5NA |
| C.标准状况下,22.4 L水所含原子数为3NA |
| D.常温常压下,48 g O3和O2的混合气体中氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.107克Fe(OH)3胶体中,含有的胶粒数目为NA |
| B.46克NO2和N2O4的混合物中,含有原子的数目为3NA |
| C.标准状况下,2.24L的Cl2溶于水中达到饱和,转移的电子数目为0.1NA |
| D.2.3克Na与O2完全反应,反应中转移的电子数目介于0.1NA与0.2NA之间 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.200 mL | B.250 mL | C.425 mL | D.560 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
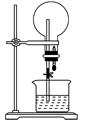
| A.溶质的物质的量浓度相同、溶质的质量分数不同 |
| B.溶质的质量分数相同,溶质的物质的量浓度不同 |
| C.溶质的物质的量浓度和溶质的质量分数都不同 |
| D.溶质的物质的量浓度和溶质的质量分数都相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,22.4 LCl2和HCl的混合气体中含原子总数为2NA |
| B.256g S8晶体中含S-S键为7NA个 |
| C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com