
【题目】下列对分子的性质的解释中,不正确的是
A.CH≡C-CH=CH-CH3 中σ键和π键数目之比为 10:3
B.![]() 分子中不含手性碳原子
分子中不含手性碳原子
C.硫难溶于水,微溶于酒精,易溶于 CS2,说明极性:水>酒精>CS2
D.由 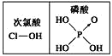 知酸性:H3PO4>HClO
知酸性:H3PO4>HClO
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)苯制备溴苯___________________。
(2)制备TNT_____________________。
(3)2溴丙烷消去反应______________。
(4)实验室制乙烯__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的密闭容器里,反应 2A(g)B(g)+2C(g)达到平衡时,A、B 和 C 的物质的量分别为 4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是( )
A.充入 1mol 稀有气体氦(He),平衡将不发生移动
B.充入A、B、C 各 1mol,平衡将向正反应方向移动
C.将 A、B、C 各物质的物质的量都减半,C 的百分含量不变
D.加入正催化剂,正逆反应速率均加快,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业废气 CO2 或 CO 和 H2 在一定条件下可制备燃料甲醇。
Ⅰ.利用工业废气 CO 合成甲醇,其能量变化示意图如下:
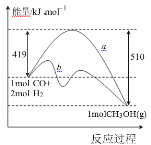
(1)图中曲线 a 到曲线 b 的措施是_______。该反应 ΔS________0(填“>”或“<”)
(2)一定条件下,在 2 L 密闭容器中充入 1 mol CO 和 2 mol H2,10 min 后达到平衡,放出热量 45.5kJ,则 10 min 内 H2 的转化率为_____;该温度下反应的平衡常数 K=_____;达到平衡后,再向容器中充入 CO、H2、CH3OH 各 1 mol,则此时 υ正_____υ逆 (填“>”“<”或“=”)
(3)下列措施可以提高甲醇产率的是_____。
a.压缩容器体积
b.将 CH3OH (g)从体系中分离
c.恒容条件下充入He,使体系总压强增大
d.恒压条件下再充入 10mol CO 和 20mol H2
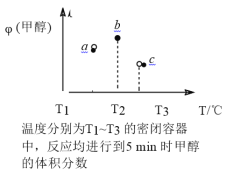
(4)现有容积均为 1L 的 a、b、c 三个密闭容器,向其中分别充入 1molCO 和 2molH2 的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。b 中甲醇体积分数大于 a 中的原因是_______达到平衡时,a、b、c 中 CO 的转化率大小关系为_______。
Ⅱ.用工业废气中的 CO2制取甲醇和水蒸气
(5)一定条件下,往2L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应 I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
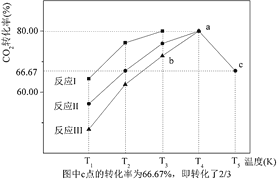
①催化剂效果最佳的反应是_____(填“反应 I”,“反应 II”,“反应 III”)。
②b 点υ正_____υ逆(填 “>”, “<”, “=”)。
③若此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因是_____。
④c点时该反应的平衡常数K=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,元素周期表的第7周期已被填满。2017年,第113号、115号、117号和118号元素有了中文名称:鉨![]() 、镆
、镆![]() 、
、![]()
![]() 、
、![]()
![]() 。已知第113号元素与
。已知第113号元素与![]() 元素同主族,根据元素周期律的知识,下列预测或说法合理的是
元素同主族,根据元素周期律的知识,下列预测或说法合理的是
A.![]() 的最高价氧化物对应的水化物可能具有两性
的最高价氧化物对应的水化物可能具有两性
B.![]() 在元素周期表中的位置是第7周期第ⅤB族
在元素周期表中的位置是第7周期第ⅤB族
C.![]() 的非金属性比
的非金属性比![]() 的弱
的弱
D.![]() 在元素周期表的所有元素中非金属性最强
在元素周期表的所有元素中非金属性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D、E 都是周期表中前四周期的元素,且原子序数依次增大,其中 A 原子核外 有三个未成对电子;A 与 B 可形成离子化合物 B3A2;C 元素是地壳中含量最高的金属元素;D 原 子核外的 M 层中有两对成对电子;E 原子核外最外层只有 1 个电子,其余各层电子均充满。以下 有关说法正确的是
A.A 离子半径小于 B 离子半径
B.B 和 C 的氯化物晶体类型相同
C.C 和 D 形成的二元化合物不能通过复分解反应得到
D.E 在周期表中位于第四周期 s 区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:H2(g)+I2(g)![]() 2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数
C. 容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用惰性电极电解200 mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)。
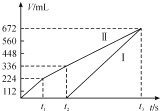
(1)曲线___(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)NaCl的物质的量浓度为___,CuSO4的物质的量浓度为___。
(3)t2时所得溶液的pH为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:___Cr2O72-+__Fe2++__H+—__Cr3++__Fe3++__H2O。现有0.12g工业甲醇,在H2SO4溶液中与25mL0.2mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1mol·L-1FeSO4与其反应,结果用去FeSO4溶液9.6mL。
(1)配平第②步的离子方程式___。
(2)计算工业甲醇的质量分数___。
(3)工业上通常利用SiO2和碳反应来制取硅,写出反应的化学方程式__。
工业上还可以利用镁制取硅,反应为2Mg+SiO2=2MgO+Si,同时会发生副反应:2Mg+Si=Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
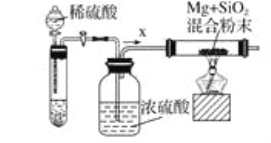
(4)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用__(填序号)。
A.石灰石 B.锌粒 C.纯碱
(5)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是__;当反应引发后,移走酒精灯,反应能继续进行,其原因是__。
(6)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃。用化学方程式表示这两个反应①___,②___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com