
分析 (1)①已知:①NO2(g)+SO2(g)+H2O(l)=H2SO4(l)+NO(g)△H=a kJ•mol-1
②2NO(g)+O2(g)=2NO2(g)△H=b kJ•mol-1
由盖斯定律可知,方程式①×2+②可得2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l),据此计算;
②铁离子具有氧化性能把二氧化硫氧化为硫酸根离子;
(2)①根据方程式中物质之间的关系计算;
②除杂质不能引入新的杂质,工业生产还有考虑成本;
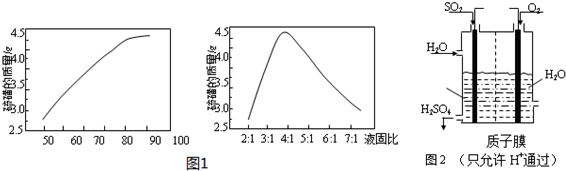
③根据题中所给的图象分析;
(3)①原电池中阳离子向正极移动;
②负极上二氧化硫失电子生成硫酸根离子.
解答 解:(1)①已知:①NO2(g)+SO2(g)+H2O(l)=H2SO4(l)+NO(g)△H=a kJ•mol-1
②2NO(g)+O2(g)=2NO2(g)△H=b kJ•mol-1
由盖斯定律可知,方程式①×2+②可得2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l),△H=2a+b kJ•mol-1,
故答案为:2a+b;
②铁离子具有氧化性能把二氧化硫氧化为硫酸根离子,则SO2通入硫酸铁溶液反应的离子方程式为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
(2)①已知:(C6H10O5)n+n H2SO4→n(C6H11O5)HSO4
n(C6H11O5)HSO4+n H2O→n C6H12O6+n H2SO4
C6H12O6+12H2SO4+12MnO2→12MnSO4+6CO2↑+18H2O
则(C6H10O5)n~~n(C6H11O5)HSO4~~n C6H12O6~~12n MnSO4
162n 1812n
xt 1t
解得x=0.09t;
故答案为:0.09t;
②除杂质不能引入新的杂质,所以不能选用ClO-、KMnO4、(NH4)2S2O8,工业生产还有考虑成本,选择软锰矿作氧化剂可以降低生成成本;
故答案为:降低成本,不增加新的杂质;
③由题中所给的图象可知,在80℃和液固比为4:1时,硫磺的萃取质量较大;
故答案为:80℃、4:1;
(3)①二氧化硫和氧气形成原电池,二氧化硫失电子为负极,氧气得电子为正极,溶液中阳离子向正极移动,所以电解质溶液中质子的流向是从负极流向正极;
故答案为:从负极流向正极;
②负极上二氧化硫失电子生成硫酸根离子,则负极电极方程式为:SO2+2H2O-2e-=SO42-+4H+;
故答案为:SO2+2H2O-2e-=SO42-+4H+.
点评 本题考查了盖斯定律的应用、氧化还原反应和离子方程式的书写、有关方程式的计算原电池原理的应用,题目涉及的知识点较多,侧重于考查学生对基础知识的应用能力和计算能力,题目难度中等,注意对有关知识的掌握以及归纳整理.


科目:高中化学 来源: 题型:选择题
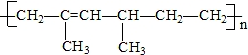
| A. | 乙烯和2-甲基-1,3-戊二烯 | B. | 2,4-二甲基-1,3-己二烯 | ||
| C. | 2,4-二甲基-2-已烯 | D. | 乙烯和2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图乙为一个金属铜的晶胞,请完成以下各题.
图乙为一个金属铜的晶胞,请完成以下各题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊不消失 | Na[Al(OH)4]溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 足量铁加入少量稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H6O | C. | C2H4O | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性强弱:HF>HCl>HBr>HI | |
| B. | 原子半径大小:Mg>S>O | |
| C. | 碱性强弱:NaOH<Mg(OH)2 | |
| D. | 金属性强弱:K>Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com