
 Na2SO4的浓度分别变为2 mol?L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
Na2SO4的浓度分别变为2 mol?L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?科目:高中化学 来源:不详 题型:单选题
| A.Fe | B.Na | C.Mg | D.Al |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化碳的相对分子质量是44 | B.“物质的量浓度”可简称为“量浓度” |
| C.阿伏加德罗常数的单位是mol-1 | D.1 mol任何物质所占体积都是22.4 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| B.53gNa2CO3固体含有的CO32-离子数为0.5 NA |
| C.室温下,21.0g乙烯和丁烯的混合气体中含有的共价键数目为3NA |
| D.5.6 g Fe和一定量的浓HNO3或稀HNO3完全反应,转移电子一定均为0.3NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.14g分子通式为CnH2n的链烃中含有的C=C的数目为NA/n |
| B.标准状况下,NO和 O2各11.2 L混合,所得混合气体的分子总数为 0.75 NA |
| C.25℃时,pH=7的NH4Cl和NH3?H2O混合溶液中,OH-离子数为10-7 NA |
| D.两份2.7g铝分别与100mL浓度为2 mol·L―1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温常压下,18g 18O2中含有NA个氧原子 |
| B.标准状况下,2.24 L水所含分子数为0.1NA个 |
| C.标准状况下,22.4 L空气含有NA个分子 |
| D.常温常压下,1.6克甲烷气体中含有的电子数为NA; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
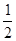 H2O)、无水石膏(CaSO4)三种成分组成,各组分含量可用下列方法测定。
H2O)、无水石膏(CaSO4)三种成分组成,各组分含量可用下列方法测定。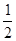 H2O,此时,其它两组分与酒精溶液不起作用;将试样取出干燥后称量,试样质量变为8.97 g。
H2O,此时,其它两组分与酒精溶液不起作用;将试样取出干燥后称量,试样质量变为8.97 g。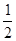 H2O都水化成CaSO4·2H2O,取出干燥后再次称量,质量变为10.32 g。
H2O都水化成CaSO4·2H2O,取出干燥后再次称量,质量变为10.32 g。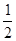 H2O)∶n(CaSO4)= __________________。
H2O)∶n(CaSO4)= __________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com