
| A. | 固体中阳离子和阴离子个数不一定相等 | |
| B. | 固体中一定有离子键可能有共价键 | |
| C. | 若X只含两种元素,所含元素一定不在同一周期也不在同一主族 | |
| D. | 固体中阳离子半径一定大于阴离子半径 |
分析 由短周期元素构成的某离子化合物X中,一个阳离子和一个阴离子核外电子数之和为20.阴、阳离子均是10电子微粒,阴离子为N3-、O2-、F-、OH-等,阳离子为NH4+、Na+、Mg2+、Al3+等,据此判断.
解答 解:由题意知阴、阳离子均是10电子微粒,阴离子:N3-、O2-、F-、OH-等,阳离子:NH4+、Na+、Mg2+、Al3+等.
A.当阴、阳离子所电荷不相等,阳离子和阴离子个数不相等,如MgF2、Na2O,当阴、阳离子所电荷相等,阳离子和阴离子个数相等,如NaF、NaOH,故A正确;
B.X是离子化合物,一定有离子键,也可能含共价键,如NaOH、Mg(OH)2、NH4F等,故B正确;
C.若X只含两种元素可以是NaF、MgF2、Na2O、Na3N等,两元素不能在同一周期也不能在同一主族,故C正确;
D.对简单的离子,阴、阳离子电子层结构相同,核电荷数越大,离子半径越小,阳离子的核电荷数一定大于阴离子的核电荷数,所以X中阳离子半径小于阴离子半径,故D错误.
故选:D.
点评 本题考查离子结构、物质结构等知识,难度中等,本题采取列举法解答,找出例外举例,列举法在元素周期表中经常利用.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
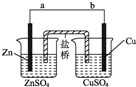 某学生利用如图实验装置探究盐桥式原电池的工作原理
某学生利用如图实验装置探究盐桥式原电池的工作原理查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL,10.6g | B. | 100mL,10.1g | C. | 500mL,10.1g | D. | 500mL,10.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L溶液中Cl-离子浓度为0.2mol•L-1 | |
| B. | 1L溶液中Cl-离子总数为0.2NA | |
| C. | 1L溶液中Ba2+离子浓度为0.2mol•L-1 | |
| D. | 1L溶液中Ba2+和Cl-离子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
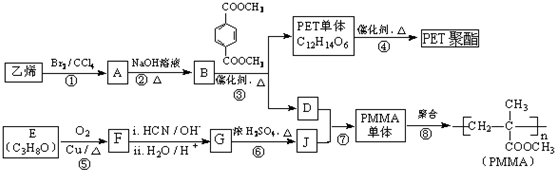
 (R、R’代表烃基)
(R、R’代表烃基)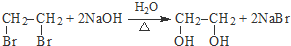 .
.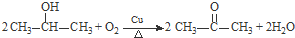 .
.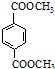 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH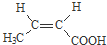 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
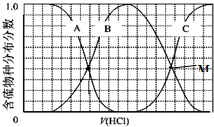 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平 衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol | |
| B. | 放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必大于amol | |
| C. | 放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4amol | |
| D. | 放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8KJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8KJ•mol-1 | |
| C. | H2(g)+O2(g)═H2O(l)△H=-285.8KJ•mol-1 | |
| D. | H2(g)+O2(g)═H2O(g)△H=-285.8KJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com