
����ʵ���У���Ӧ�������Լ����۶���ȷ���� �߾��������ϵ����
�߾��������ϵ����
ѡ�� | ʵ�� | ���� | ���� |
A | ��ϡ���������������У���ַ�Ӧ��μ�KSCN��Һ | ���������ɣ���Һ��Ѫ��ɫ | ϡ���ὫFe����ΪFe3+ |
B | ��ͭ�ۼ�1��0mol•L-1Fe2��SO4��3��Һ�� | ��Һ�������к�ɫ������� | ��������ͭ���� |
C | ������ǯ��סһС����ɰֽ��ϸ��ĥ���������ھƾ����ϼ��� | �ۻ����Һ̬���������� | ���������۵�ϵ� |
D | ��0��1mol•L-1 | ���а�ɫ�������ɣ�����dz��ɫ���� | Cu��OH��2���ܶȻ���Mg��OH��2��С |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017����������������и��������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���������ָ�������£�һ���ܴ����������
A��pH��1����ɫ��Һ��Na����Cu2����NO3����SO42��
B����ʹ�⻯�ص�����ֽ��������Һ��K����Fe2����SO42����Cl��
C��ˮ�������c��H������10��12mol/L����Һ��Ba2����Na����Cl����NO3��
D�����ܽ�Al��OH��3�������Һ��K����Na����HCO3����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ�������¿�����ѧ�Ծ��������棩 ���ͣ�������
��һ����������Ļ����Һ��ȡ��10mL��������BaCl2��Һ�����ˡ�ϴ�ӡ���ɺ�õ�9.32g�ij�������Һ��4mol��L-1NaOH��Һ��Ӧ����ȥ40mLNaOH��Һʱǡ����ȫ�к͡�����
��1 �����Һ��H2SO4��HNO3�����ʵ���Ũ�ȸ��Ƕ��٣�
�����Һ��H2SO4��HNO3�����ʵ���Ũ�ȸ��Ƕ��٣�
��2����ȡ10mLԭ���Һϡ����80mL������4.48gͭ�۹���ʱ���ռ��������ڱ�״���µ����Ϊ���ٺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ�������¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
�ⵥ����ˮ��Һ���ܽ�Ⱥ�С������CCl4���ܽ�Ⱥܴ�������Ϊ�� ��
A.CCl4��I2����������С����H2O��I2���������ϴ�
B.CCl4��I2����ֱ���ͷ��ӣ���H2O����ֱ���ͷ���
C.CCl4��I2��������Ԫ�أ���H2O�к�����Ԫ��
D.CCl4��I2���ǷǼ��Է��ӣ���H2O�Ǽ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ�������¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
����c��FeCl3����0.3 mol��L��1��c��FeCl2����0.15 mol��L��1�Ļ����Һ�еμ�ϡNaOH��Һ���ɵõ�һ�ֺ�ɫ��ɢϵ�����з�ɢ��������ֱ��ԼΪ9.3 nm�Ľ�������������й�˵������ȷ���ǣ� ��
A���÷�ɢϵ�ķ�ɢ��ΪFe2O3
B������NaOHʱ�����ķ�Ӧ����Ϊ��Fe2����2Fe3����8OH��=Fe3O4��4H2O
C���ڵ糡�����£�����������ɢϵ��ɫ�����˵���÷�ɢϵ�������
D�����ù��˵ķ�������ɫ������������Na�����뿪
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ���¿�����ѧ���������棩 ���ͣ�ʵ����
һƿ��Һ�п��ܺ���Mg2+��Na+��OH����Cl����CO32����SO42����ij���֣��ֱַ�ȡ����Һ����װ����֧�Թܣ���������ʵ�飺
�����һ֧�Թ��НC���̪��Һ����Һ��죻
����ڶ�֧�Թ��м�������BaCl2��Һ�����ɰ�ɫ���������ˣ�������Һ�������֧�Թܣ��ڳ����м���ϡ���ᣬ��������ʧ������ɫ��ζ���������������ͨ�����ʯ��ˮ��ʯ��ˮ����ǡ�
�������֧�Թ����ȼ��������ữ���ټ�����������Һ�����ְ�ɫ������ͨ������ʵ����ж���Һ�к�������Ϊ �������е�����Ϊ ����ȷ���Ƿ��е�����Ϊ ��д��ʵ��ڢ��������йط�Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ���¿�����ѧ���������棩 ���ͣ�ѡ����
�����£����и���������ָ ����Һ��һ���ܴ����������
����Һ��һ���ܴ����������
A��pH=12����Һ�� ��
�� ��
��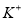 ��
��
B����ʹ��̪������Һ�У� ��
�� ��
�� ��
��
C��0.1mol/L��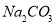 ��Һ�У�
��Һ�У� ��
�� ��
�� ��
��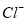
D����ɫ����Һ�У� ��
�� ��
��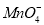 ��
��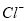
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶�������ѡ��ѧ���������棩 ���ͣ�ѡ����
��֪X��YԪ��ͬ���ڣ��ҵ縺��X>Y������˵���������
A. ��һ�����ܣ�Xһ������Y
B. ��̬�⻯����ȶ��ԣ�HmY����HnX
C. ��ۺ���������ԣ�X��Ӧ������ǿ��Y��Ӧ������
D. X��Y�γɻ�����ʱ��X�Ը��ۣ�Y������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ĸ��������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�ܱ������г�������ʵ�����A��B��һ���¶��·�����ӦA(g)+xB(g)  2C(g)���ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı�Ӱ�췴Ӧ��һ��������������������ʵ����ʵ���Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯����ͼ��ʾ������˵������ȷ����
2C(g)���ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı�Ӱ�췴Ӧ��һ��������������������ʵ����ʵ���Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯����ͼ��ʾ������˵������ȷ����

A��30��40 min��÷�Ӧʹ���˴���
B����Ӧ����ʽ�е�x��1������ӦΪ���ȷ�Ӧ
C��30 minʱ�����¶ȣ�40 minʱ�����¶�
D��8 minǰA��ƽ����Ӧ����Ϊ0.08 mol��L-1��min-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com